1 锂离子固体电解质及其基础电学与电化学性能
1.1 锂离子固体电解质的定义
锂离子固体电解质在工作温度条件下为固态,其载流子为Li+,离子电导率可以达到10-4~10-2 S/cm,电导活化能Ea < 0.5 eV(48.24 kJ/mol),电子电导率应低于10-8 S/cm。锂离子固体电解质的离子电导率服从Arrhenius定律,即:σT=Aexp(-Ea/kBT),其中σ为离子电导率;T为温度;kB为Boltzmann常数;A为指前因子。
1.2 锂离子固体电解质的发展
自20世纪70年代至今,锂离子固体电解质已有近五十年的发展历史。表1汇总了半个世纪以来材料体系的发展历程。开发高性能固体电解质的目的是为了发展固态电池,以下结合固态电池对电解质的基础性能要求阐述材料体系的发展现状。
表 1 锂离子固体电解质发展历程
Table 1
| 电解质 | 结构 | 典型组分 | 电导率/S·cm-1 | 时间 |
|---|---|---|---|---|
| Li3N[1] | 层状 | Li3N单晶,Li3N多晶 | 1×10-3,4×10-4(25℃) | 1970’s | 1990’s |
| Li3N-LiI-LiOH | 9.5×10-4(25℃) | |||
| Li4SiO4及相关相[2] | 单斜晶系结构 | Li4SiO4,Li4(Si0.6Ti0.4)O4 | 2×10-5,5×10-4(300℃) | |
| Li3Mg0.5SiO4 | 1.5×10-2(400℃) | |||
| Li9SiAlO8 | 2.3×10-7(25℃) | |||
| γⅡ-Li3PO4类型结构 | Li3.6Si0.6P0.4O4 | 1×10-4(100℃) | ||
| Li5AlO4及相关相[3] | 反萤石结构 | Li5.9Al0.1Zn0.9O4 | 1.5×10-3(300℃) | |
| Li5.5Fe0.5Zn0.5O4 | 7×10-3(300℃) | |||
| LISICON结构[4,5] | γⅡ-Li3PO4类型结构 | Li14Zn(GeO4)4 | 1.25×10-3(300℃) | |
| Li3.6Ge0.6V0.4O4 | 4×10-5(25℃) | |||
| Li2SO4及相关相[6] | 体心立方结构 | LiNaSO4 | 1(550℃) | |
| LiKSO4 | 0.3(500℃) | |||
| Li4Zn(SO4)3 | 1(500℃) | |||
| Li0.22Na1.33Zn0.22SO4 | 0.1(300℃) | |||
| Li2.5P0.5S0.5O4 | 1.5×10-3(300℃) | |||
| 尖晶石结构 | Li2MnCl4,Li2MgCl4 | 0.14(400℃) | ||
| Li2CdCl4,Li2CdI4 | 0.3(400℃), 0.1(300℃) | |||
| Li3InCl6 | 1.4×10-3(27℃) | |||
| Li2ZnCl4 | 2×10-4(280℃) | |||
| 锂的钙钛矿型 | 钙钛矿结构[9] | Li0.29La0.57TiO3 | 1×10-5(25℃) | 1990’s | 现在 |
| 反钙钛矿结构[10] | Li3OCl | 1×10-3(25℃) | ||
| LiM2(PO4)3 (M=Zr, Ti, Ge, Hf) [11] | NASICON类型结构 | Li0.1Zr0.1Ta0.9(PO4)3 | 6×10-6(25℃) | |
| Li1.3Al0.3Ti1.7(PO4)3 | > 10-3(25℃) | |||
| Li1.5Al0.5Ge1.5(PO4)3 | > 10-4(25℃) | |||
| Li5+xLa3M2O12 (M=Nb, Ta, Zr) [12,13] | 石榴石结构 | Li5La3Ta2O12 | ~10-6(25℃) | |
| Li6BaLa2Ta2O12 | 4.0×10-5(25℃) | |||
| Li6.5La3Zr1.5Ta0.5O12 | 1×10-3(25℃) | |||
二元硫化物玻璃陶瓷 (100-x)Li2S-xP2S5(摩尔分数)为主体 | Li8P2S9晶相+Li2S [14] | 80Li2S-20P2S5 | 7.2×10-4(25℃) | |
| β-Li3PS4晶相 [15] | 75Li2S-25P2S5及相关相 | 5.8×10-4(25℃) | ||
| Li7P3S11晶相 [16] | 70Li2S-30P2S5及相关相 | 3.2×10-3(25℃) | ||
| Li7P2S8I晶相 [17] | Li7P2S8I | 2×10-3(25℃) | ||
| Li7P2S8Br0.5I0.5 | 4.7×10-3(25℃) | |||
三元硫化物陶瓷 Li2S-MS2-P2S5 (M=Si, Ge, Sn) 或者 Li2S-MSx-LiX (M=P, Si, Ge) | 单斜结构,thio-LISICON [18] | Li3.25Ge0.25P0.75S4 | 2.2×10-3(25℃) | |
| 四方结构,thio-LISICON [19,20,21] | Li10GeP2S12 | 1.2×10-2(25℃) | ||
| Li11Si2PS12 | 4.0×10-3(25℃) | |||
| Li9.54Si1.74P1.44S11.7Cl0.3 | 2.5×10-2(25℃) | |||
| 硫银锗矿结构,Li-Argyrodite [22,23,24] | Li6PS5Cl | 4.7×10-3(25℃) | ||
| Li5.5PS4.5Cl1.5 | 1.2×10-2(25℃) | |||
| Li6.6P0.4Ge0.6S5I | 1.8×10-2(25℃) |
(1)固体电解质应具备高离子电导率,其数值在工作温度条件下应高于1 mS/cm。3 C电子与动力锂电池的工作场景温度范围是-20~60 ℃。目前,只有少数硫化物体系锂离子固体电解质的离子电导率可以在-20 ℃低温条件中达到1 mS/cm。大部分氧化物与聚合物固体电解质在25 ℃中无法达到1 mS/cm,它们的电导性能与液体电解质相差较大。不过,使用溅射方式可制备厚度仅为1~2 μm的电解质薄膜,减少离子电导率较低的固体电解质贡献的内阻,例如基于金属锂负极、LiPON电解质和LiCoO2正极的薄膜电池已经被用于严苛环境中的特殊器件中。此外,固体电解质具有不挥发、热稳定性高的特点,且在高温环境中其离子电导率更高,适合开发高温电池器件。
(2) 固体电解质的电子电导率与离子电导率比值应小于10-4。绝大部分电解质材料满足该条件。
(3)固体电解质在工作温度范围内对正极、负极活性材料稳定。目前固体电解质与电极材料的稳定性的研究相对较少,不同体系的电解质材料与不同电极材料的匹配性需要作更深入的研究和探讨。
1.3 锂离子固体电解质的分类
常见的锂离子固体电解质种类有3种,分别为氧化物、硫化物和聚合物。(1)氧化物固体电解质可在空气中制备,配套设备成本相对较低;不过,氧化物只有烧结成致密陶瓷才能拥有高于10-4 S/cm的离子电导率。(2)硫化物固体电解质必须在惰性气氛中制备,配套设备成本高;不过,硫化物无需烧结成致密陶瓷,粉体状态压制成型后即可拥有高离子电导率。(3)聚合物固体电解质需要在干燥气氛中制备,其在室温条件下离子电导率很低,需升温到60 ℃以上、或者向聚合物中添加有机小分子使其能够在室温下凝胶化才能正常工作。值得注意的是,不论是凝胶化还是升温后的聚合物电解质本身都呈现一定的流动性,这与氧化物、硫化物两类无机固体电解质有着本质的不同。
1.4 锂离子固体电解质的基础电化学性能
(1) 离子电导率 锂离子电解质的作用是在电池中传导锂离子到正负极活性物质材料颗粒表面,因此,离子电导率是电解质最为重要的性能。参照液体电解质,其室温离子电导率达到5×10-3 S/cm以上;此外,液体电解质可以良好的浸润于正负极活性物质颗粒间,构建正负电极处的三维离子导电网络。在全固态电池中,正极活性材料与固体电解质之间为固固接触。如需在室温中达到与液体电解质类似的与电极材料的接触效果,一方面需提高固体电解质相对于正极材料的质量/体积比例,另一方面则要求固体电解质本身具有类似甚至超过液体电解质的离子电导率。在半固态电池中,固体电解质仅被用作隔膜,则要求其贡献的内阻低。厚度低于100 μm、离子电导率大于1×10-3 S/cm的固体电解质隔膜贡献的阻抗数值低于10 Ω·cm2,满足使用标准。
(2) 电子电导率 锂离子固体电解质的另一个作用是隔开正负电极,其电子电导率应当极低以减少电池的自放电。
(3) 电化学窗口 锂离子固体电解质应当在电池充放电过程中不发生电化学分解。
(4) 锂/固体电解质界面稳定性 金属锂负极在液体电解质中存在严重的副反应和锂枝晶短路问题,利用固体电解质替代液体电解质可能解决此类问题。此外,由于金属锂负极是实现超过350 W·h/kg的高比能锂电池的必经之路[25],故而固体电解质与金属锂接触润湿性,稳定性以及锂嵌入/脱出过程中的界面稳定性均非常重要。
2 离子电导率的测试
2.1 交流阻抗谱法测量锂离子固体电解质的离子电导率
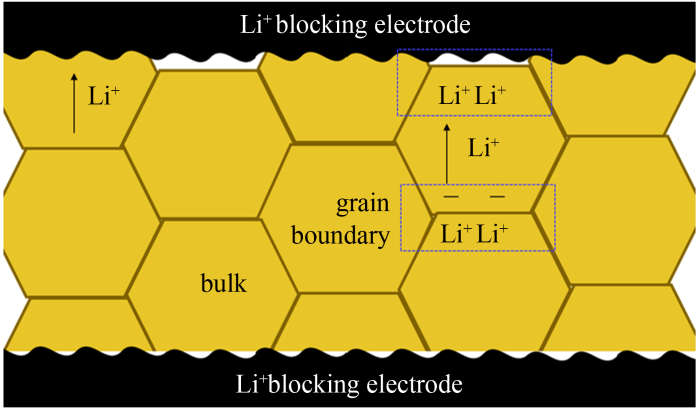
交流阻抗法是在被测体系处于平衡状态下,通过输入不同频率内的小幅度正弦波电压(或电流)交流信号,对所测量体系响应的频谱信号进行分析,进而得出该体系在不同频率下的阻抗,构成图谱。该方法被广泛应用于测量锂离子固体电解质的离子电导率[26]。根据阻塞电极(本文指Li+阻塞电极)/电解质/阻塞电构型构建对称电池,然后使用电化学阻抗谱设备测量该电池的阻抗谱,再分析谱图数据确定电解质自身贡献的总阻抗,最后结合被测电解质样品的尺寸计算该样品的锂离子电导率数值。如图1所示,以Li7La3Zr2O12(LLZO)陶瓷为例[27],在电场扰动下,晶粒内Li+迁移,由于晶界离子电导率较低,晶界两侧分别富集Li+正电荷与消耗Li+负电荷形成正负电荷双电层,即“容抗信息”。阻抗谱中即可观察到晶界贡献的电阻-电容并联电路的R-C半圆。当阻塞电极与电解质之间接触完美时,Li+在电极附近的动力学过程类似于半无限扩散,其在阻抗谱中表现为45°的直线。R-C半圆与该直线的拐点的实部数值为LLZO陶瓷的总阻抗R。通过公式σ=L/(R×S)(L为厚度,S为电极有效面积)计算LLZO电解质样品的总离子电导率。
图1
图1
阻塞电极/LLZO/阻塞电极对称电池在电场扰动下锂离子迁移形成容抗的示意图
Fig.1
The scheme of capacitive reactance generated by electric field disturbance in Blocking Electrode/LLZO/blocking electrode symmetry cell
阻塞电极/固体电解质/阻塞电极的常见的阻抗谱测量曲线(Nyquist plot)如图2所示。如果阻塞电极自身、阻塞电极与电解质之间的固固接触、阻抗谱测量设备是完美的,那么阻抗谱曲线如图2(a)所示。对应的拟合电路为(RbQb)(RgbQgb)Wel,其中R是纯电阻(resistance),Q是常相位角元件(constant phase element),W是Warburg阻抗;b指电解质晶粒体相(bulk),gb指晶界(grain boundary);el指阻塞电极(electrode)。锂离子固体电解质晶粒内Li+在晶格格位上的迁移的响应频率很高,室温下达到10 MHz甚至100 MHz以上。普通阻抗谱设备难以检测。Li+在晶界处的迁移响应频率相对较低,根据材料体系的不同为10 kHz到10 MHz不等。上述物理实体体现在阻抗谱图上为两个容抗弧。
图2
图2
阻塞电极/锂离子固体电解质/阻塞电极对称电池的(a)理论阻抗谱曲线和(b)~(d)典型的实测曲线图
Fig.2
(a) theoretical Nyquist plot and (b)~(d) typical measured Nyquist plots of blocking electrode/Li-ion solid electrolyte/blocking electrode symmetry cell at room temperature
在实验中,阻塞电极自身、阻塞电极与电解质的界面接触并非完美。此外,阻抗谱设备频率检测上限和高频区的检测误差性能是有限的。当制作的阻塞电极及其界面状态良好、设备性能良好时,测得的阻抗谱曲线如图2(b)所示。高频区可以观察到电解质晶界响应的全部或者部分容抗弧,低频区则观察到阻塞电极响应的一段角度大于45°的曲线。相应的拟合电路为Rb(RgbQgb)(RelQel)。
如图 2(c)所示,如果阻塞电极制作较差或者阻塞电极与电解质接触较差,阻抗谱图中在晶界响应的容抗弧后出现阻塞电极与电解质的界面响应的容抗弧。相应的拟合电路为Rb(RgbQgb)(RSE/elQSE/el)(RelQel),其中SE/el指固体电解质与阻塞电极之间的界面。
如图2(d)所示,如果阻塞电极制作良好,电解质样品直径较大,厚度较薄,或者电解质样品离子电导率较高(如升温至60 ℃的LLZO),本体晶界阻抗数值较小,那么晶界容抗信号强度低,晶界半圆消失。由引线和设备内组件引入的感抗将干扰对称电池的检测信号,在阻抗谱图中表观为位于第四象限的高频区曲线。此外,当阻抗谱设备性能较差时,高频区检测信噪比差,那么即使样品直径小、厚度大,晶界容抗信号也会被感抗信号淹没,阻抗谱曲线表观为一条从第四象限出发,穿过Z′轴的曲线。曲线和Z′轴的交点的Z′数值是电解质样品的总阻抗数值。
图2为作者根据多年实验结果总结的图像。阻抗谱谱图的解析需要根据采用的阻塞电极材质、电极制作状态、电解质体系和样品制备状况综合考虑,以确保解析准确。
2.2 测试影响因素分析与实例
使用交流阻抗谱法测量锂离子固体电解质的电导率时,影响测试结果的常见因素如表2所示。其中测试设备、阻塞电极和电极引线对结果的影响较大,本文作具体分析。
表 2 锂离子固体电解质交流阻抗谱测试中的影响因素
Table 2
| 因素 | 影响方式 | 建议 |
|---|---|---|
| 测试设备 | 设备性能、老化、不当使用造成高频区精度下降 | 购买需注意设备误差图、使用中注意维护 |
| 阻塞电极 | 电极材质与电解质反应、电极疏松、接触差引入的额外的容抗、阻抗信息 | 确保样品表面无杂质、选用惰性材料和物理溅射方法制作电极、施加压力改善界面接触 |
| 电极引线 | 长导线引入感抗和纯电阻 | 选用低线阻的双绞屏蔽线 |
| 偏压 | 偏压大,电解质内受扰动大,反馈信号强,信噪比上升 | 惰性阻塞电极可设定100 mV以上偏压 |
| 温度 | 温度上升,电解质电导率上升,容抗信息减小,信噪比下降 | 降低温度有助于提升信噪比 |
| 样品尺寸 | 直径大,厚度小,电解质本身贡献的阻抗信息小,信噪比下降 | 样品直径不宜过大,厚度应适当增加 |
2.2.1 测试设备
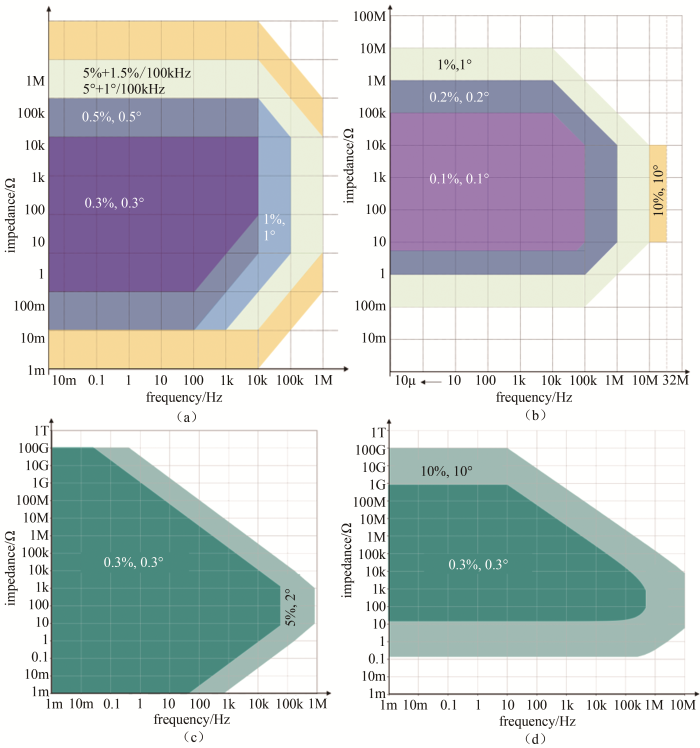
拥有阻抗谱测试功能的的电化学工作站品牌与型号繁多,性能差别较大。如图3所示,以Solartron 1470E+1455A(下文简称1455A),Solartron 1260A(下文简称1260A),Autolab PGSTAT302N+FRA32M(下文简称FRA32M),Autolab ECI10M+PGSTAT302N+FRA32M(下文简称ECI10M)4种设备的误差图说明它们的性能差异。一般的,频率高、样品阻抗数值过大或者过小,阻抗谱设备的检测误差则会较大。如果样品的阻抗为10~1000 Ω,4种设备在频率为20、5、0.9 MHz时的误差如表3所示。对比可知,英国输力强公司(Solartron Co. Ltd.)的1260A的性能优异,同品牌的1455A性能较差。瑞士万通公司的Autolab ECI10M的性能相对较好,接近1260A;FRA32M的性能一般,好于1455A。然而,作者在实验中使用1260A设备测量样品时,高于10 MHz频率区域出现乱点,达不到厂商标称的性能。原因可能有二:一是设备高频元件老化,误差增大;二是超高频检测时容易受到测量系统,即仪器设备本身、导线和电极的微小的感抗、容抗信息干扰,信噪比低。
图 3
图 3
(a)Solartron 1470E+1455A;(b)Solartron 1260A;(c)Autolab PGSTAT302N+FRA32M和(d)Autolab ECI10M+PGSTAT302N + FRA32M阻抗谱设备的误差图
Fig.3
Error maps of (a) Solartron 1470E+1455A, (b) Solartron 1260A, (c) Autolab PGSTAT302N+FRA32M and (d) Autolab ECI10M+PGSTAT302N+FRA32M impedance analyzers
表 3 4种阻抗谱设备高频区误差
Table 3
| 阻抗谱设备 | 阻抗误差/%及相位角误差/(°) | ||
|---|---|---|---|
| @20 MHz | @5 MHz | @0.9 MHz | |
| Solartron 1470E+1455A (1455A) | N/A | N/A | ±5%, ±5° |
| Solartron 1260A (1260A) | ±10%, ±10° | ±1%, ±1° | ±0.2%, ±0.2° |
| Autolab PGSTAT302N+FRA32M (FRA32M) | N/A | N/A | ±2%, ±5° |
| Autolab ECI10M+PGSTAT302N+FRA32M (ECI10M) | N/A | ±10%, ±10° | ±0.3%, ±0.3° |
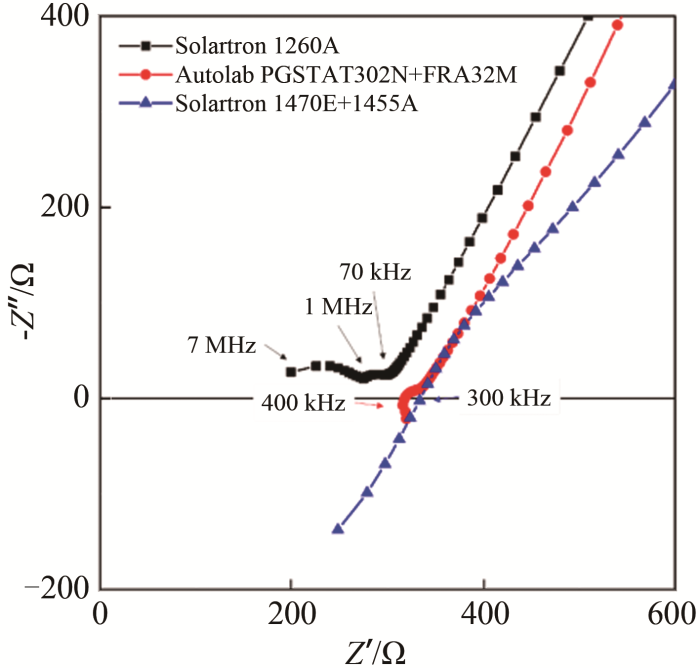
浙江锋锂新能源科技有限公司(以下简称为“浙江锋锂”)提供了Li6.4La3Zr1.4Ta0.6O12陶瓷片样品,其致密度约为97%(理论密度5.5 g/cm3)、尺寸为φ13.5 mm×2.0 mm。使用南京南大LZ-II离子溅射仪在陶瓷片表面镀金制作阻塞电极,测试环境温度约为25~28 ℃。1260A、1455A和FRA32M三种设备测试该样品的结果如图4所示。其中1260A测试的阻抗谱图(方块)符合图2(c)中讨论的模型。7~1 MHz频率范围内的容抗弧对应于陶瓷片的晶界,1 MHz~70 kHz频率范围内的容抗弧对应于制作较差的阻塞电极与陶瓷界面,低于70 kHz的尾线为电极扩散Warburg阻抗。使用FRA32M测得阻抗谱图中晶界半圆消失。图3(c)表明,FRA32M的最大测量频率为1 MHz,无法测量到1 MHz以上的晶界阻抗。使用1455A测得阻抗谱图中晶界、界面容抗弧均消失,仅为一条从第四象限起始的曲线。图 3(a)表明,1455A在100kHz~1 MHz范围内的误差高达±5%,因此而无法准确测量得到界面容抗弧。
图 4
图 4
1260A、FRA32M和1455A测量Au/Li6.4La3Zr1.4Ta0.6O12/Au对称电池的阻抗谱图
Fig.4
Nyquist plots of Au/Li6.4La3Zr1.4Ta0.6O12/Au symmetry cell measured via 1260A, FRA32M and 1455A
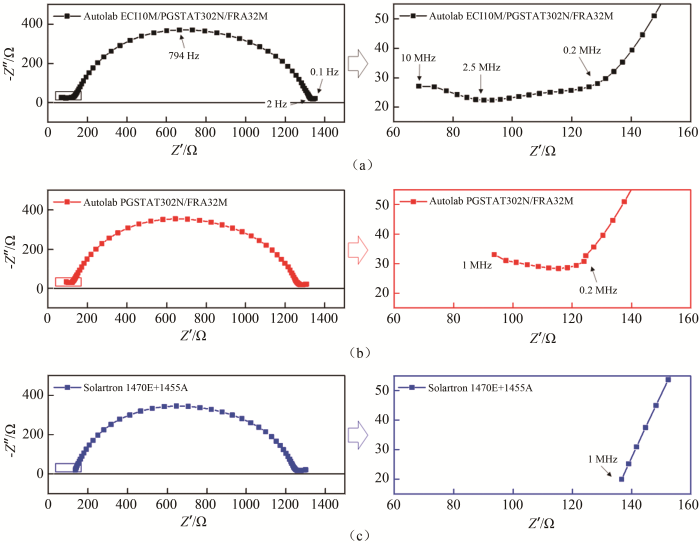
如图 5所示,以锂片为可逆电极、LAGP薄片为电解质、电解液为润湿层构建对称电池,分别使用ECI10M、FRA32M、1455A测量其阻抗谱,结果如图 6所示。其中LAGP薄片由浙江锋锂提供,其组分为Li1.5Al0.5Ge1.5(PO4)3、致密度约为97%(理论密度3.25 g/cm3)、尺寸为φ15 mm×0.3 mm。测试环境温度约为25~28 ℃。该样品中贡献容抗弧的物理实体有:电解质片内晶界;电解质片与电解液界面;电解液与锂片界面;锂离子在可逆电极锂片内的扩散及电化学转移。如图 6(a)所示,ECI10M测量得到的阻抗谱图的信息相对完善:10~2.5 MHz的容抗弧对应于电解质片内部晶界;2.5~0.2 MHz容抗弧可能对应于电解液与锂片的界面;0.2 MHz~2 Hz容抗弧可能对应于电解质片与电解液界面;1~0.1 Hz平短弧对应于锂离子在锂电极内的扩散和电化学转移。如图 6(b)所示,FRA32M的测量结果丢失了10~2.5 MHz的电解质晶界容抗弧。如图6(c)所示,1455A的测量结果进一步丢失了1~0.2 MHz的容抗信息。
图 5
图 5
锂/电解液/LAGP薄片/电解液/锂对称电池(a)示意图与(b)、(c)实物图
Fig.5
(a)scheme and (b)、(c) digital pictures of Li/liquid electrolyte/LAGP membrane/liquid electrolyte/Li symmetry cell
图 6
图 6
(a)ECI10M;(b)FRA32M和(c)1455A测量锂/电解液/LAGP/电解液/锂对称电池的阻抗谱图
Fig.6
Nyquist plots of Li/liquid electrolyte/LAGP/liquid electrolyte/Li symmetry cell measured via (a) ECI10M, (b) FRA32M and (c) 1455A
上述两例实验结果表明,阻抗谱设备的性能对测试结果有不可忽略的影响。不同于液体电解质,锂离子固体电解质的晶格响应频率极高、晶界响应频率较高,对阻抗谱设备的高频性能要求较高。建议根据电解质材料体系的特性和设备厂商提供的误差图选择合适的设备作锂离子固体电解质的交流阻抗谱测试。
2.2.2 阻塞电极
对称电池的离子阻塞、电子导通电极材料一般选用金、银、铂、钢、碳等。阻塞电极自身应致密以降低电阻,其与电解质表面应紧密接触以消除界面阻抗。对于聚合物薄膜,使用抛光硬质钢片;对于氧化物陶瓷片,蒸镀金、银、铂等惰性金属电极;对于硫化物电解质片,使用软碳片或者铟片。
硬质氧化物固体电解质陶瓷样品表面的抛光度会影响阻塞电极的制备结果,进而影响阻抗谱测试。浙江锋锂提供了Ta、Nb掺杂的LLZO陶瓷片样品各3片,组分分别为Li6.5La3Zr1.5Ta0.5O12和Li6.5La3Zr1.5Nb0.5O12,下文简称Ta1-3和Nb1-3。样品尺寸为φ10 mm×(2~3) mm。陶瓷片经金刚砂磨盘粗抛光后,乙醇超声洗净表面,然后使用中科科仪SBC-12离子溅射仪蒸镀金阻塞电极,作阻抗谱测试。测试完毕后将陶瓷片表面电极粗抛光,使用1200~2000目金相砂纸精抛光至光亮,乙醇超声洗净表面,重新蒸镀金电极,作阻抗谱测试。阻抗谱设备为ECI10M,环境温度约25 ℃,测量结果如图7所示。如图7(a)和图7(c)所示,粗抛光的Ta1-3和Nb1-3陶瓷片的阻塞电极表面光泽暗淡。这些样品的阻抗谱曲线包含10~1 MHz的晶界容抗弧和1 MHz~20 kHz的电解质/阻塞电极界面容抗弧,与图 2(c)相符,说明阻塞电极与陶瓷片接触较差。如图 7(b)和图7(d)所示,精抛光的Ta1-3和Nb1-3样品的阻塞电极表面色泽良好、反光。这些样品的阻抗谱曲线仅包含10~2 MHz的晶界容抗弧,与图2(b)相符,说明阻塞电极与样品接触良好。
图 7
图 7
粗、精抛光的Li6.5La3Zr1.5Ta0.5O12 (Ta1-3)、Li6.5La3Zr1.5Nb0.5O12 (Nb1-3)陶瓷样品的阻塞电极照片和归一化阻抗谱图:(a)Ta1-3粗抛光;(b) Ta1-3 精抛光;(c)Nb1-3 粗抛光;(d)Nb1-3 精抛光
Fig.7
Pictures of Blocking Electrode and normalized Nyquist plots of Li6.5La3Zr1.5Ta0.5O12 (Ta1-3)、Li6.5La3Zr1.5Nb0.5O12 (Nb1-3) ceramic samples under rough or precise polishing: (a) Ta1-3@rough, (b) Ta1-3@precise, (c) Nb1-3@rough and (d) Nb1-3@precise polishing
阻塞电极制作较差时,其与电解质接触较差,所测得的界面容抗弧会干扰研究者对电解质贡献的阻抗的判断。以第一、二个容抗弧间的拐点的Z′数值为总阻抗,和以第二个容抗弧与电极扩散尾线间的拐点的Z′数值为总阻抗,二者相差较大。阻塞电极制作较好时,阻抗谱曲线只有一个容抗弧,其与扩散尾线的拐点的Z′数值即为电解质贡献的总阻抗。表 4汇总了以上3种类阻抗数值计算得到的离子电导率,其中精抛光样品测量得到的锂离子电导率数值相对较高。
表 4 不同确认总阻抗方式计算得到的锂离子电导率数值
Table 4
| 样品编号 | 计算的离子电导率@25℃ (×10-4 )/S.cm-1 | ||
|---|---|---|---|
| 粗抛 第一个半圆截止点 | 粗抛 第二个半圆截止点 | 精抛 半圆截止点 | |
| Ta1 | 7.69 | 5.94 | 8.08 |
| Ta2 | 7.92 | 6.15 | 8.24 |
| Ta3 | 7.99 | 6.24 | 7.99 |
| Nb1 | 7.40 | 4.73 | 7.84 |
| Nb2 | 7.46 | 4.82 | 7.62 |
| Nb3 | 7.16 | 4.47 | 7.86 |
对空气湿度敏感的LLZO系氧化物电解质的阻塞电极较难制作。NASICON、钙钛矿等对湿度不敏感的体系则相对容易。聚合物、硫化物固体电解质自身较软,外部施加压力后可改善与抛光钢片、碳片的接触。针对不同材料体系,选择合适的阻塞电极,确保电极自身完好和与电解质表面接触良好,是测试得到样品准确阻抗数据的重要前提。
2.2.3 电极引线
部分场合的测试需引线连接测试样品与阻抗谱设备。如锂离子固体电解质的变温阻抗测试,需将样品置于高低温交变箱中,样品与设备通过长引线连接。长引线会引入额外的电阻和电感干扰信号。
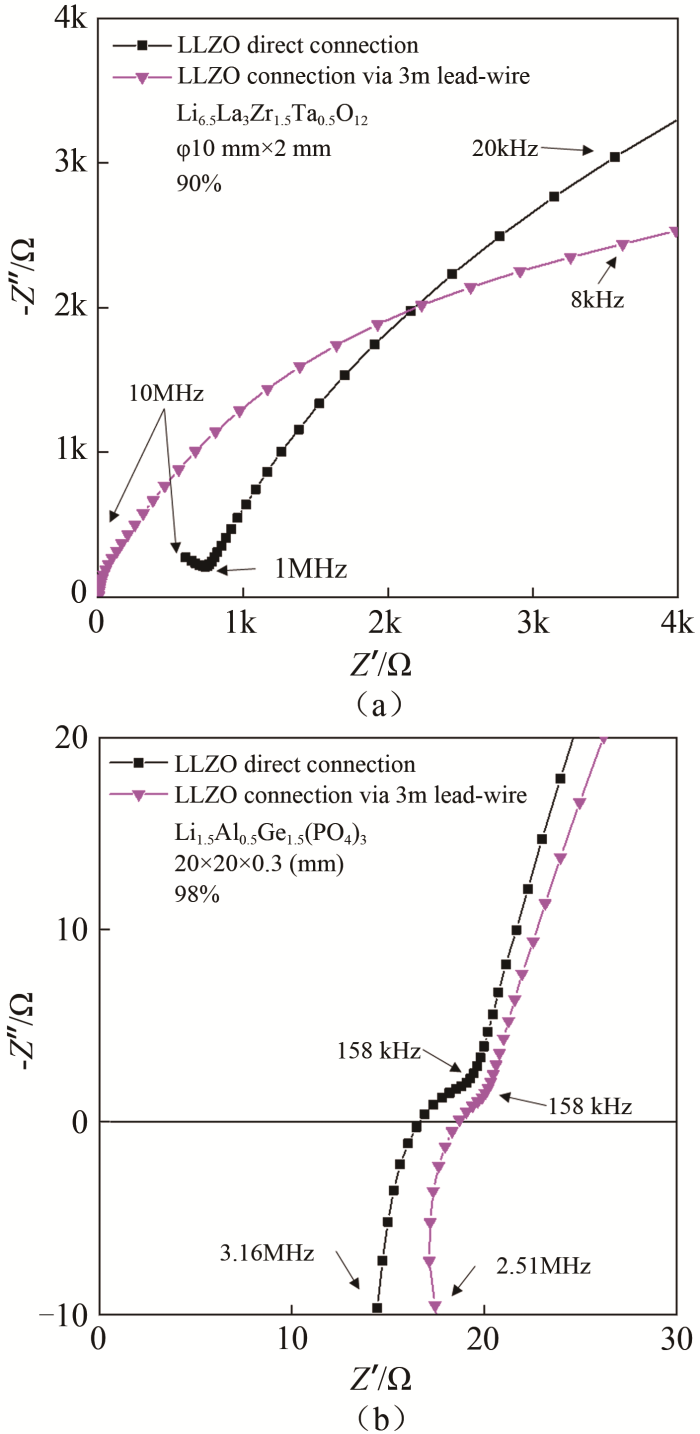
针对LLZO陶瓷片(Li6.5La3Zr1.5Ta0.5O12,致密度90%,φ10 mm×2 mm,浙江锋锂提供)和LAGP陶瓷膜[Li1.5Al0.5Ge1.5(PO4)3,致密度98%,20 mm×2 mm×0.3 mm,浙江锋锂提供],使用中科科仪SBC-12蒸镀金作为阻塞电极,选用3 m国标RVVP 4 mm×0.75 mm四芯屏蔽线作为长引线,其四芯分为两组,各组拧合连接样品与ECI10M设备的电极作测试。测试环境温度约为25 ℃,结果如图8所示。LLZO直连设备可测得晶界容抗弧和电极扩散的尾线,而通过3 m长引线连接设备作测试,晶界容抗弧信息丢失。LAGP直连与通过引线连接设备的谱图形状相近,长引线贡献了约0.2 Ω线阻。LLZO的晶界响应频率达1 MHz以上,LAGP则为100 kHz以上,长引线可能对阻抗谱高频测量精度产生较大的影响,因此响应频率高的LLZO的晶界容抗信号丢失,而响应频率低的LAGP不受影响。
图 8
图 8
(a)LLZO陶瓷片和(b)LAGP陶瓷膜,直接连接或通过3 m引线连接ECI10M测试的阻抗谱图
Fig.8
Nyquist plots of (a) LLZO ceramic pellet and (b) LAGP ceramic membrane directly or via 3 m lead-wire connected to ECI10M
2.2.4 偏 压
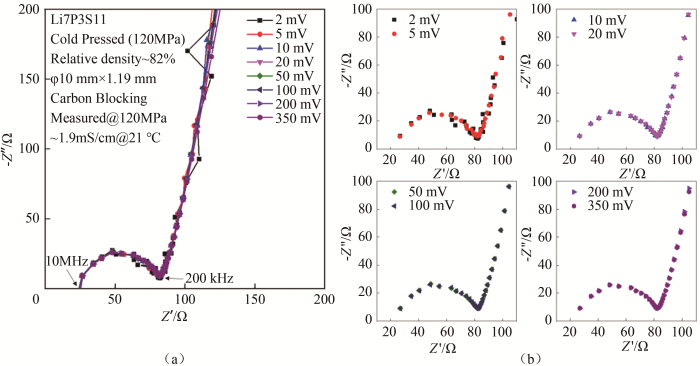
对于锂离子固体电解质与阻塞电极构建的对称电池,通常使用恒压模式(potentiostatic mode)测量阻抗谱。在可逆电极对称电池系统和开路电压不为零的非对称电池系统中,施加的偏压数值需尽可能小以确保系统处于平衡态。而在阻塞电极对称电池系统中,固体电解质中的锂离子受电场影响在晶格、晶界以及阻塞电极界面处迁移和扩散,只要低于电解质的分解电压则不发生电化学反应,因此偏压大小不会影响到电解质自身的平衡态。实际测试中,增高偏压有利于提高被测样品抗干扰强度,进而提高反馈到设备的信号强度,增加信噪比,提高测量精度。
将浙江锋锂提供的Li7P3S11粉体于120 MPa压制成φ10 mm×1.19 mm片,以碳片为阻塞电极,施加120 MPa压力以确保阻塞电极与电解质片接触良好,使用ECI10M,施加2~350 mV偏压,测量该样品的阻抗谱。如图9(a)所示,测得的阻抗谱曲线重合,即偏压对阻塞电极构建的对称电池的阻抗谱测试无影响。如图9(b)所示,当偏压过小,信噪比较低时,阻抗谱测量点连续性差;当偏压大于10 mV时,测量点连续性良好。需要注意的是,以金属锂可逆电极构建的对称电池系统在作交流阻抗谱测量时电解质与电极界面可能发生锂溶出和沉积反应。中高频率时单向施加偏压的时间极短,锂的溶出与沉积难以发生或者锂溶出/沉积量极少,不影响对称电池稳态;在低或极低频率时,单向施加偏压时间长(例如0.001 Hz对应1000 s施加偏压时间),当偏压较大,对称电池内阻较低时,对称电池内电流较大,锂溶出/沉积量大,影响对称电池稳态。分析结果时需考虑电解质/电极界面处的电化学反应:Li++e-⇌Li。
图 9
图 9
偏压数值对阻抗谱测试结果的影响:(a)2~350 mV合并;(b)分项谱图
Fig.9
Influence of bias value on impedance results. Nyquist plots of (a) all 2~350 mV and (b) separated measurements
2.3 氧化物、硫化物、聚合物锂离子固体电解质离子电导率测试实例
2.3.1 氧化物
氧化物锂离子固体电解质的粉体冷压成型素坯的离子电导率很低,低于10-6 S/cm,必须经高温烧结成致密陶瓷、降低晶界阻抗后才能达到10-4~10-3 S/cm,因此亦称为氧化物陶瓷电解质[28]。该类材料质脆,强度高,热稳定性高,离子电导率偏低,制备难度较大。
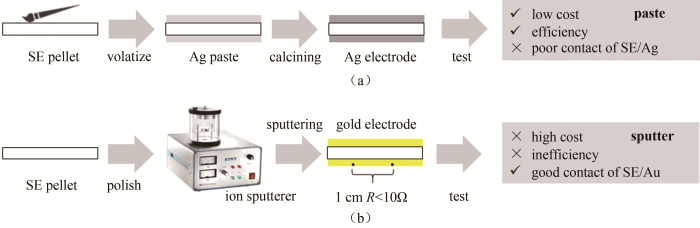
如图 10所示,将氧化物陶瓷表面抛光平整至反光,去除表面杂质后,通常采用涂浆和溅射两种方式制备阻塞电极。银浆中的溶剂和黏结剂应在热处理中不与电解质发生化学反应。鉴于银颗粒通过黏结剂和物理吸附粘附到电解质片表面,制备的阻塞电极与电解质的接触较差。相对而言,溅射法制作的电极与电解质片的接触较好。氧化物电解质中对湿度相对稳定的组分,例如NASICON结构的LAGP和LATP,溅射参数无需调校即可制备得面电阻小、接触良好的电极。而对湿度敏感的组分,例如LLZO,则需在相对湿度低于50%的环境中抛光样品表面至反光后,尽快转移至离子溅射仪腔体内,抽真空到10 Pa以下,加高电压调整电流到2~10 mA。如果溅射设备的高电压强度不足以电离空气,则可以向腔体内通入易电离的氩气。制作的阻塞电极应平整、光亮,1 cm距离面电阻数值应小于10 Ω。如果制作的电极差,则需将电极抛光去除,重新调整参数溅射电极。
图 10
图 10
氧化物陶瓷电解质的阻塞电极制备方式:(a)涂浆法;(b)溅射法
Fig.10
(a) Pasting and (b) sputtering method for preparation of blocking electrode for oxide ceramic electrolytes
图 11为3种氧化物固体电解质(石榴石,NASICON,钙钛矿)陶瓷(LLZTO和LAGP由浙江锋锂提供,LLTO参考文献[29])的典型的阻抗谱曲线。如图11(a)所示,LLZTO样品的晶界响应频率较高,当样品直径大、厚度薄,1260A无法准确测量晶界容抗信号;在高频区受到引线和设备本身内部感抗的影响,阻抗谱图为一条从第四象限出发穿过Z′轴的曲线。此时曲线和Z′轴的交点的Z′数值为电解质贡献的总阻抗,依此计算电解质的离子电导率数值约为1×10-3 S/cm。如图11(b)所示,当减小样品直径、增加厚度后,设备可以检测到晶界容抗信号,阻抗谱图为容抗弧和紧随其后的电极扩散尾线。此时容抗弧与尾线的拐点的Z′数值为电解质的总阻抗,依此计算的离子电导率数值同样为1×10-3 S/cm。上述两个样品的组分一致,致密度类似,测量得到的锂离子电导率数值一致。NASICON结构的LAGP陶瓷的晶界响应频率相比于石榴石结构的LLZTO低,如图11(c)所示,即使样品薄,也能测量到清晰的晶界响应信号。值得注意的是,高频区10~2 MHz范围内因感抗干扰谱图中含第四象限的曲线。根据容抗弧与扩散尾线的拐点的Z′数值计算得到的离子电导率数值为3×10-4 S/cm。钙钛矿结构的LLTO的晶界容抗信号明显,如图11(d)所示,根据拐点计算得到的离子电导率数值为4×10-4 S/cm。
图 11
图 11
25 ℃室温中氧化物电解质的典型的归一化阻抗谱图。(a)和(b)分别为Li6.5La3Zr1.5Ta0.5O12陶瓷薄片和厚片;(c) Li1.5Al0.5Ge1.5(PO4)3陶瓷膜;(d) Li3xLa2/3-xTiO3陶瓷薄片[29]
Fig.11
Normalized Typical Nyquist plots of oxide solid electrolytes at room temperature 25 ℃. (a) and (b) is thin and thick Li6.5La3Zr1.5Ta0.5O12 ceramic pellet, respectively; (c) Li1.5Al0.5Ge1.5(PO4)3 ceramic membrane; (d) Li3xLa2/3-xTiO3 ceramic sheet[29]
氧化物固体电解质陶瓷的阻抗谱结果的准确分析需与致密度、断面微观结构结合,确定不同频域的阻抗谱曲线对应的物理实体,进而确定电解质贡献的总阻抗,准确计算锂离子电导率。
2.3.2 硫化物
图 12
图 12
LGPS的(a)粉体;(b)冷压成型素坯;(c)陶瓷片
Fig.12
(a) powder, (b) cold pressed pellet and (c) ceramic pellet of LGPS
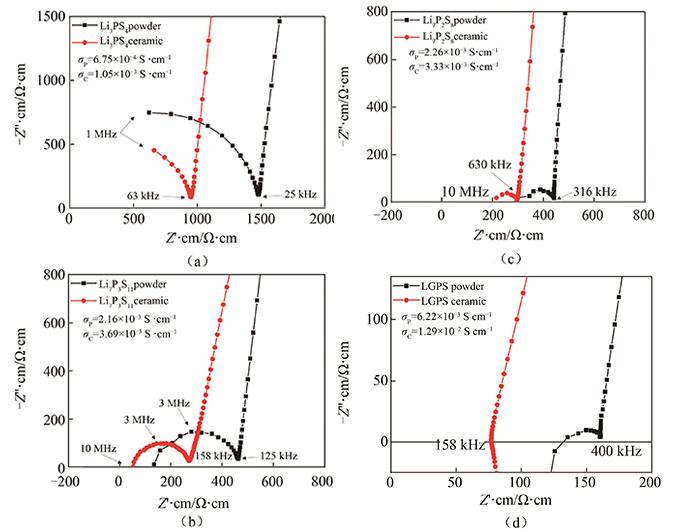
图 13
图 13
(a)Li3PS4;(b)Li7P3S11;(c)Li7P2S8I和(d)LGPS粉体冷压成型(powder)和烧结陶瓷(Ceramic)的归一化阻抗谱图
Fig.13
Normalized Nyquist plots of cold-pressed pellets (powder) and sintered ceramic pellets (ceramic) of (a) Li3PS4, (b) Li7P3S11, (c) Li7P2S8I and (d) LGPS
对于冷压成型素坯或者韧性较好的陶瓷,例如Li3PS4、Li7P3S11、Li7P2S8I和LGPS,使用碳片、不锈钢片和铟片作为阻塞电极,两侧施加30 MPa以上的压力即可实现阻塞电极与电解质表面的良好接触。碳片的制作流程:刮刀法将碳浆涂布到薄铝箔上,烘干后模切成碳片电极。
对于韧性差的陶瓷,例如硫银锗矿结构的Li6PS5Cl,可以使用以下3种方法制备阻塞电极:①涂低温银浆,低于100 ℃挥发后得到阻塞电极。银浆溶剂和添加剂与电解质不发生化学反应。②离子溅射蒸镀惰性金属电极。③铟片较软,夹住样品,施加较小压力,可于陶瓷不碎的条件下与电解质表面接触良好。
浙江锋锂提供了Li3PS4,Li7P3S11,Li7P2S8I和LGPS 4种硫化物电解质粉体,将粉体冷压成型和烧结成陶瓷,并测量这些样品在室温中的阻抗谱。制备与测试参数如表 5所示,样品直径均为10 mm,厚度为1~3 mm,阻塞电极为碳片。为统一对比,所有样品的阻抗谱数据对各自尺寸作归一化处理。如图13(a)所示,Li3PS4的离子电导率较低,使用高频性能较弱的FRA32M即可测量观察到电解质晶粒与晶界容抗弧。该弧与电极扩散尾线的拐点处的Z′∙cm数值的倒数即样品的锂离子电导率。Li3PS4陶瓷电导率可以达到1 mS/cm,高出其冷压电导率50%。如图13(b)、(c)所示,Li7P3S11、Li7P2S8I的离子电导率较高,使用高频性能较好的ECI10M设备可测量观察到晶界容抗弧。与Li3PS4类似,Li7P3S11和Li7P2S8I的陶瓷电导率分别达到3.69 mS/cm和3.33 mS/cm,高出它们各自的冷压电导率70%和47%。如图13(d)所示,LGPS冷压成型素坯的离子电导率为6.22 mS/cm,其阻抗谱图中可观察到晶界容抗弧;LGPS陶瓷样品的离子电导率高达12.9 mS/cm,其阻抗谱图为一条从第四象限出发穿越Z′·cm轴的曲线。硫化物电解质在烧成陶瓷过程中晶界处低电导率物质反应、融合、结晶,晶界电导得到大幅度提升,因此其陶瓷电导率高于冷压电导率。
表 5 4种硫化物固体电解质的制备和测试参数
Table 5
| 电解质组分 | 主相 | 冷压成型压力/MPa | 陶瓷制备方式 | 测量施加压力/MPa | 测量设备 | 环境温度/℃ (冷压/陶瓷) |
|---|---|---|---|---|---|---|
| Li3PS4 | β-Li3PS4 | 120 | 前驱体玻璃冷压后烧结成瓷 | 60~120 | FRA32M | 26.1/28.1 |
| Li7P3S11 | Li7P3S11 | 120 | 前驱体玻璃冷压后烧结成瓷 | 60~120 | ECI10M | 25.1/25.6 |
| Li7P2S8I | Li7P2S8I低温相 | 120 | 前驱体玻璃冷压后烧结成瓷 | 60~120 | ECI10M | 29.0/25.1 |
| LGPS | Li10GeP2S12 + Li3.25Ge0.25P0.75S4 | 240 | 电解质粉体冷压后烧结成瓷 | 120~180 | ECI10M | 21.1/27.0 |
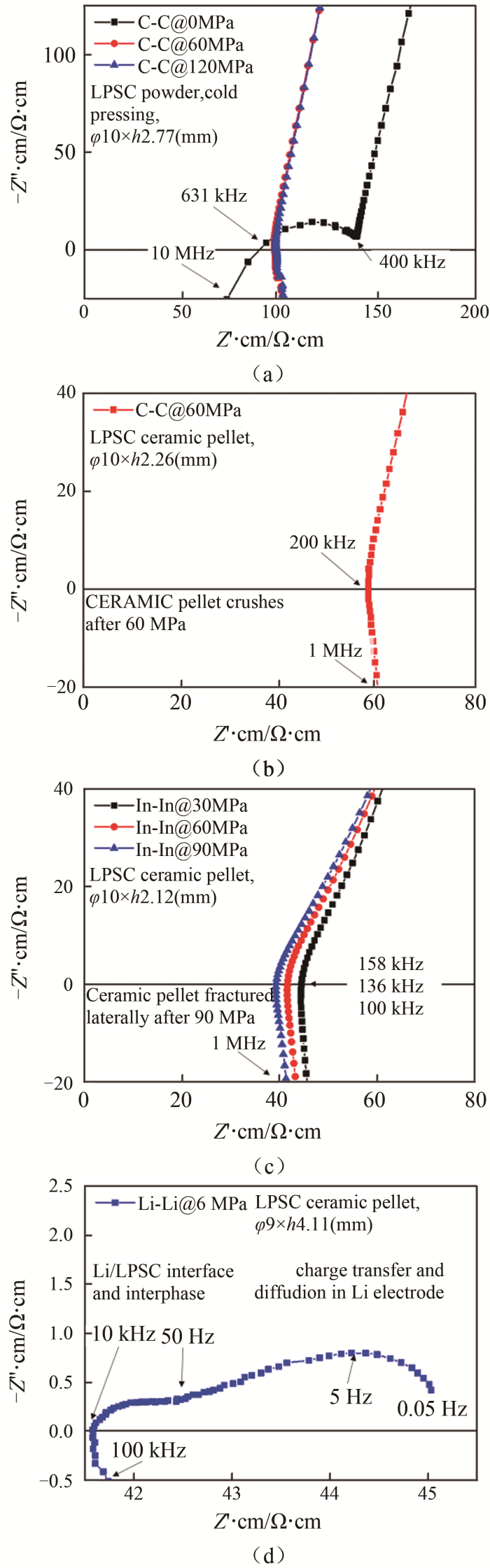
对于高锂离子电导率硫化物电解质Li5.4PS4.4Cl1.6(LPSC,浙江锋锂提供)的冷压成型素坯和烧结陶瓷,选用碳片、铟片和金属锂3种电极制作对称电池,并在30~120 MPa不同压力下测试阻抗谱。测试设备为ECI10M,环境温度约为27~30 ℃。如图14(a)所示,LPSC冷压素坯在120 MPa和60 MPa压力时,阻抗谱曲线为一条跨越Z′轴的曲线,此时测量得到的离子电导率达到1.09×10-2 S/cm。撤掉压力后,电解质晶界接触变差,容抗信号明显,曲线出现晶界容抗弧,离子电导率测量值为7.5×10-3 S/cm。将冷压成型素坯烧结成瓷,如图14(b)所示,使用碳片电极时,加压60 MPa改善碳电极与电解质陶瓷的界面接触则造成脆性陶瓷片彻底碎裂。此时离子电导率的测量值达到1.72×10-2 S/cm。如图14(c)所示,使用较软的铟电极做测试,在低于60 MPa压力时陶瓷片未碎裂,然而达到90 MPa时陶瓷片横向断裂,厚度变薄,计算得到的电导率数值偏高。因此以铟电极60 MPa压力下的离子电导率测量值作为陶瓷的电导率,为2.4×10-2 S/cm。此外,使用比金属铟软的锂作为可逆电极,施加6 MPa即可改善锂与LPSC陶瓷的界面接触,结果如图14(d)所示。其中100~10 kHz的直线与Z′轴的交点的数值为LPSC陶瓷贡献的总阻抗;10 kHz~50 Hz的容抗弧对应于陶瓷与锂的界面;50~0.05 Hz的半圆对应于金属锂电极内扩散。以此计算得到的离子电导率数值为2.4×10-2 S/cm,与使用铟电极测量得到的数值相同。
图 14
图 14
LPSC对称电池的阻抗谱图:(a)冷压素坯碳片电极;烧结陶瓷(b)碳片;(c)铟;(d)锂电极
Fig.14
Nyquist plots of LPSC symmetry cells. (a) cold pressed pellet with carbon electrode; sintered ceramic with (b) carbon, (c) indium and (d) lithium electrodes
不同硫化物电解质组分的物性差异较大,需根据电解质组分特性选用合适的阻塞电极,必要时选用多种电极协同测试,以准确测定电解质的离子电导率。
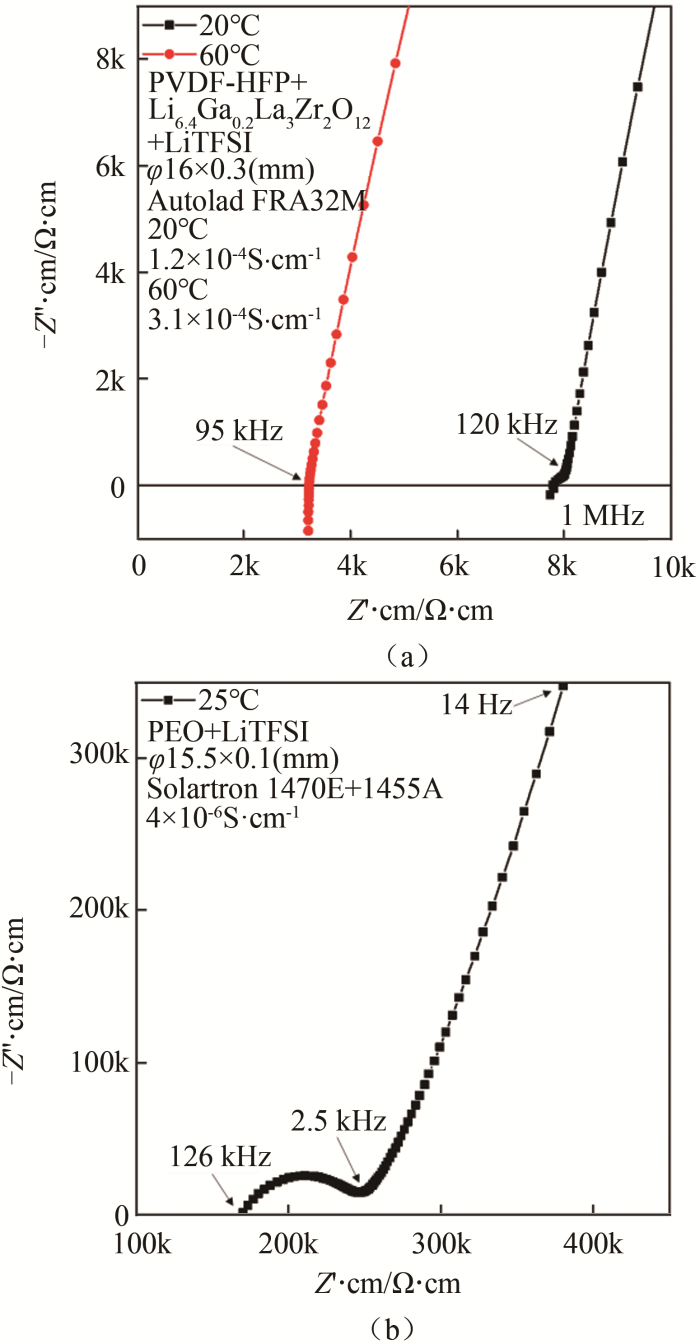
2.3.3 聚合物
如图 15所示,使用抛光钢片作为阻塞电极,两侧加弹簧片,使用扣式电池壳装配得到对称电池。如果聚合物电解质与钢片电极接触较差,可以预先60~80 ℃热处理2~8 h,改善接触。相比于氧化物和硫化物,聚合物电解质的阻塞电极成本低廉,操作简便。聚合物电解质膜较软,施加压力后厚度略微改变,厚度较难准确测量。如图16(a)所示,凝胶聚合物膜(中科院上海硅酸盐所温兆银研究员团队提供)在20 ℃下可以观察到小半圆。该半圆可能源于阻塞电极与电解质的接触界面或者电解质本身的畴区晶界。此温度下电解质的离子电导率为1.2×10-4 S/cm。升温到60 ℃后,半圆消失,离子电导率提升至3.1×10-4 S/cm。如图16(b)所示,干聚合物(中科院宁波材料所姚霞银研究员团队提供)在25 ℃下可以观察到完整的容抗弧,源于结晶状态的干聚合物内部畴区晶界,离子电导率为4×10-6 S/cm。
图 15
图 15
聚合物固体电解质制作阻塞电极电池方法示意图
Fig.15
Scheme of the preparation of the symmetry cell with blocking electrodes for solid polymer electrolytes
图 16
图 16
(a)凝胶;(b)干聚合物固体电解质的典型阻抗谱图
Fig.16
Typical Nyquist plots of (a) gel and (b) dry solid polymer electrolytes
3 电子电导率的测试
3.1 双阻塞电极直流极化法
图 17
图 17
直流极化法测锂离子电解质电子电导率的示意图
Fig.17
Scheme of DC polarization method for measuring electronic conductivity of Li-ion solid electrolytes
值得注意的是,实际测试中需要长达1 h以上的时间达到稳态,耗时过长,测试时间通常为2~30 min,尚未达到稳态;此外,稳态电流达到10-9 A甚至更低,超过大部分电化学工作站设备的检测极限。考虑以上两点,实际测量得到的稳态电流应大于电解质本身电子贡献的电流,即实际测量的电子电导率一般高于电解质实际的电子电导率。
3.2 双阻塞电极直流极化测量电子电导率实例
高电导率LPSC粉体(浙江锋锂提供)冷压成型后,使用电化学工作站Autolab PGSTAT302N施加恒电压0.5 V直流极化1800 s,测得的电流-时间曲线如图 18所示。当极化时间超过1200 s时,测量电流数值已经降低到10-9 A级,此后设备测量的电流数值出现波动。以1700~1800 s的平均电流数值作为稳态电流计算样品的电子电导率,数值为1.3×10-8 S/cm,比该电解质的离子电导率测量值低6个数量级。
图 18
图 18
硫化物固体电解质的直流极化测试实例
Fig.18
Example of DC polarization test of sulfide solid electrolyte
3.3 双阻塞电极直流极化法注意事项
由于固体电解质的电子电导率较低,实际测量中电流数值快速降低到10-8 A以下,对电化学工作站的电流精度要求高。此外,环境条件扰动对痕电流测试影响较大,应维持被测系统所处环境的稳定。施加的极化电压应低于被测电解质的分解电压,否则电解质电化学分解,贡献干扰电流。石榴石结构锂离子固体电解质陶瓷对空气中湿度不稳定,长时间直流极化过程中电解质与水的离子交换反应将贡献干扰电流,故需作惰性气氛或者干燥环境保护处理。
4 电化学窗口的测试
4.1 Hebb-Wagner电池构型和循环伏安测试方法
图 19
图 20为Li/LGPS/Au Hebb-Wagner构型电池,Kanno教授等[19]对其作-0.5~5 V,1 mV/s循环伏安扫描。首先从开路电压扫描至-0.5 V,该过程中金属锂可逆电极中的锂溶出,即
图 20
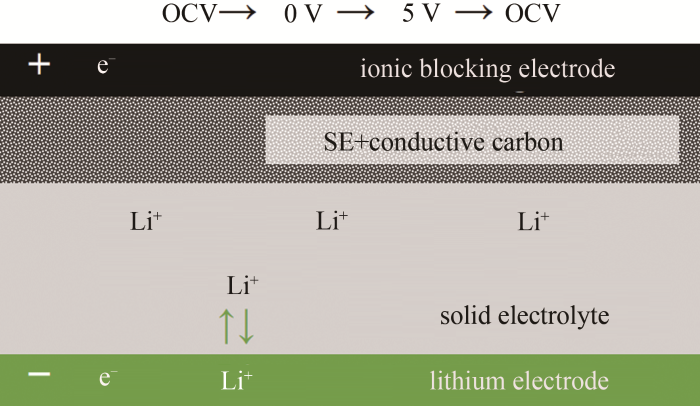
4.2 改进的Hebb-Wagner电池构型和循环伏安测试方法
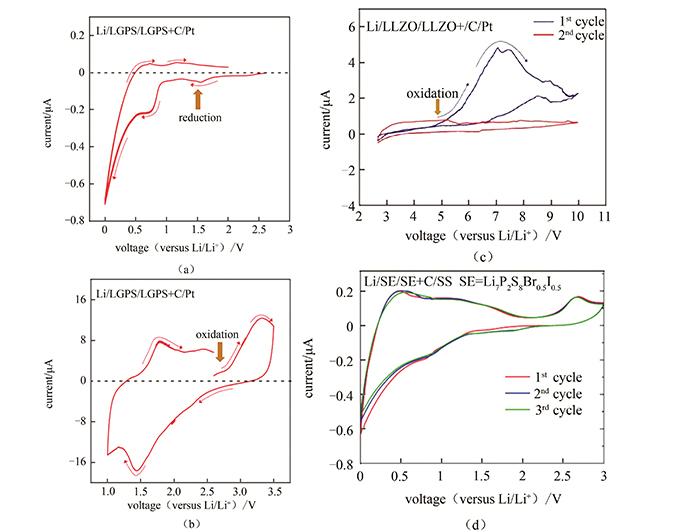
莫一飞、王春生教授[36]对图19中的电池构型作了改进,如图 21所示,在离子阻塞电极和锂离子固体电解质之间添加固体电解质和导电碳的混合层。导电碳大幅度增大了固体电解质颗粒与电子的接触面积,将固体电解质的氧化、还原电流信号放大。此外,循环伏安扫描应避免0 V以下的金属锂可逆电极的溶出和阻塞电极的沉积峰,即扫描电压范围应设定为正值。基于此改进构型的Hebb-Wagner电池测量LGPS、LLZO和Li7P2S8Br0.5I0.5的电化学窗口,结果如图 22所示。其中,LGPS在2.5~0 V内还原峰明显,还原电流高达0.7 mA;在1.0~3.5 V内出现氧化峰,强度比还原峰低两个数量级。该结果说明LGPS高电压、低电压均不稳定,电化学窗口仅为1.7~2.5 V。如图 22(c)所示,LLZO固体电解质在高于5 V电压时出现氧化峰。如图22(d)所示,Li7P2S8Br0.5I0.5与LGPS类似,低于1.0 V时电解质被还原,高于2.5 V时电解质被氧化。
图 21
图 22
硫化物固体电解质的电化学窗口较窄,氧化物电解质则相对较宽。电化学窗口的准确测量需规避锂的溶出沉积峰。
5 金属锂/固体电解质界面稳定性测试
5.1 锂与固体电解质间的固固接触
不同于液体电解质与电极活性物质之间的良好润湿,固体电解质与金属锂之间的固固接触较差,界面阻抗较高。如图23所示,对于LLZO等氧化物固体电解质,采用蒸镀金属界面层,或者涂覆诸如石墨、磷酸等界面改善层,将锂片熔融到电解质表面,以此来改善金属锂与LLZO陶瓷表面的润湿性,降低界面阻抗。对于硫化物固体电解质,可以对电解质表面作修饰,或者对金属锂表面作修饰,甚至不作修饰,施加足够大的压力即可让金属锂与电解质界面接触良好。
图 23
如图24(a)所示,Ta掺杂LLZO固体电解质陶瓷片(浙江锋锂提供)经镀金熔锂后制作得到的对称电池的阻抗谱图中200~1 kHz频率范围内的容抗弧对应于电解质与锂的界面,以此推算Li/LLZTO界面阻抗为3 Ω·cm2,说明固体电解质与锂的界面接触良好。如图24(b)所示,LPSC固体电解质片(浙江锋锂提供)的表面未做任何修饰,将金属锂放置于电解质片上下表面,施加12 MPa压力压实,再维持6 MPa恒压,制作对称电池。其阻抗谱曲线的10 kHz~0.01 Hz频率范围内的扁平半圆包含被金属锂还原分解的电解质表层和金属锂与电解质片界面的容抗信息。以该扁平半圆的直径计算得到的Li/LPSC界面阻抗数值约为1 Ω·cm2。
图 24
图 24
(a)氧化物Ta-LLZO和(b)硫化物LPSC固体电解质的锂-锂对称电池阻抗谱
Fig.24
Nyquist plots of Li-Li symmetry cells of (a) oxide Ta-LLZO and (b) sulfide LPSC solid electrolytes
5.2 锂/固体电解质/锂对称电池的短路
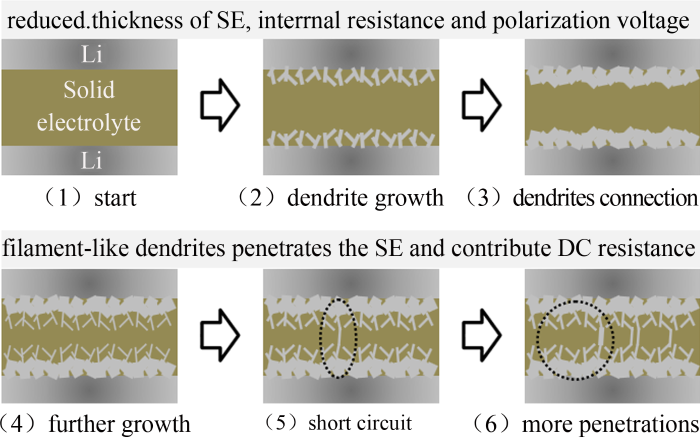
金属锂/固体电解质的界面在金属锂溶出-沉积过程中的稳定性有两个方面的内容:一是对称电池可以承受的最大的电流密度,即极限电流密度(critical current density,CCD);二是对称电池在长循环过程中的稳定性。如图25所示,对称电池在锂溶出沉积过程中,锂枝晶可沿着电解质的晶界生长,当大量枝晶形成后,相当于削减了电解质的厚度,电池内阻降低,表观在电压-时间曲线上是电压数值的突然下降。随着锂枝晶的进一步生长,当少数几根锂枝晶沿着晶界生产到相互接触后,对称电池即短路。由于电解质晶界极为狭窄,锂枝晶截面积很小,贡献的电子电阻数值大于5 Ω,因此对称电池的内阻数值并不会降低至零。在电压-时间曲线中表观为电压突降。
图 25
图 25
锂/固体电解质/锂对称电池的锂枝晶生长示意图
Fig.25
Scheme of the growth of lithium dendrites in Li/solid electrolyte/Li symmetrical cell
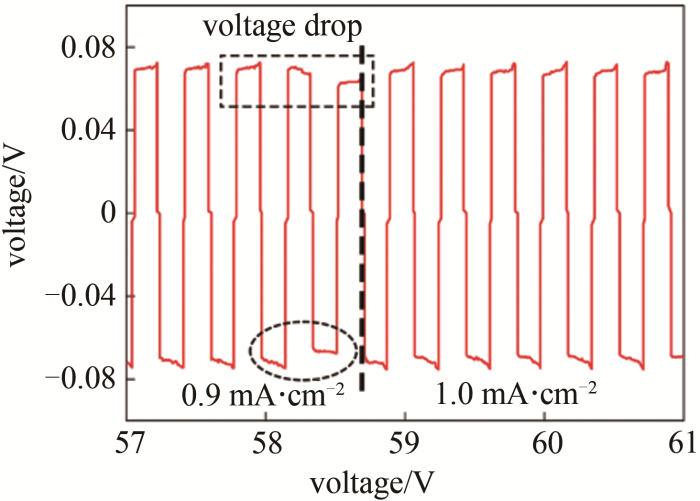
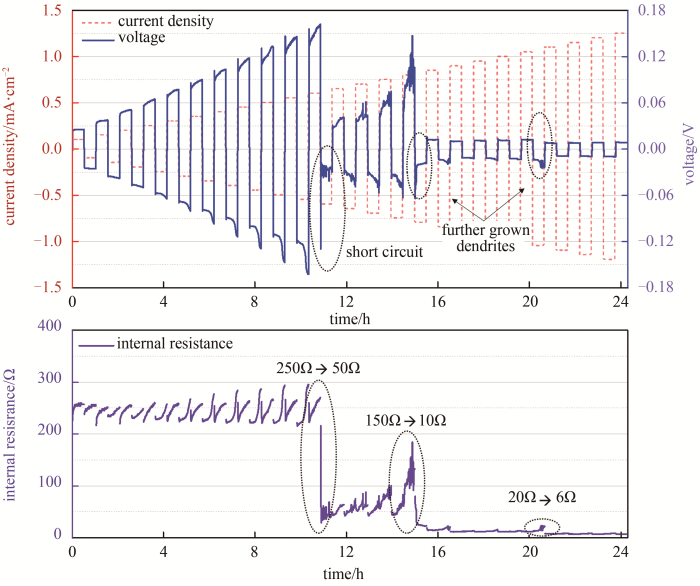
如图 26所示,温兆银等[42]使用Li-Al合金改善Li与LLZO陶瓷界面接触,制作Li/LLZO/Li对称电池,于0.9~1.0 mA/cm2电流密度,单次循环时间20 min作倍率测试。在0.9 mA/cm2与1.0 mA/cm2切换前出现电压小幅度突降现象,即发生图25中所述(3)微短路现象。固体电解质的锂对称电池作锂溶出、沉积过程中,电池内阻包含电解质本体阻抗、电解质与金属锂界面阻抗以及锂溶出沉积的电化学转移极化阻抗。随着溶出-沉积量增大和电流增大,电解质如无枝晶穿刺,其阻抗应不变;而界面、极化阻抗则随着锂溶出沉积量的增大、电解质/锂界面有效接触变少而增大;那么对称电池的电压应增加。观察到电压下降,即电池内阻降低,界面与极化阻抗只可能增大,那么说明电解质本身贡献的阻抗变小,即发生了微短路。
图 26
如图27所示,温兆银等[43]通过镀金熔锂方法改善Li/Ta-LLZO界面并构建对称电池,并作初始电流为0.1 mA/cm2,倍率增加步长为0.05 mA/cm2,单步溶出-沉积时间为30 min的倍率测试。随着电流增加,溶出-沉积量从0.05 mA·h/cm2增加到0.3 mA·h/cm2,极化电压增加,电池内阻上升,随后在0.65 mA/cm2电流密度工步中电压骤降,电池内阻从250 Ω降低至50 Ω,电池微短路,相当于电解质厚度减少到短路前的1/5。此后随着电流进一步增大,电池在0.85 mA/cm2电流密度工步中再次电压骤降,电池内阻从150 Ω下降到10 Ω,电池短路。此时锂枝晶穿刺电解质,电解质相当于离子-电子混合导体,随着电流持续增大,锂枝晶缓慢长粗,电池内阻进一步下降到6 Ω。
图 27
电流、锂溶出-沉积容量增大,对称电池短路的概率增大。如图27所示,逐渐增加对称电池的测试电流密度和锂溶出-沉积面容量,达到某一电流密度时电池短路,则称该电流密度为在其相应的锂溶出沉积面容量条件下的极限电流密度(critical current density,CCD)。锂/固体电解质界面越稳定,CCD的数值越大。
5.3 锂/固体电解质/锂对称电池的长循环
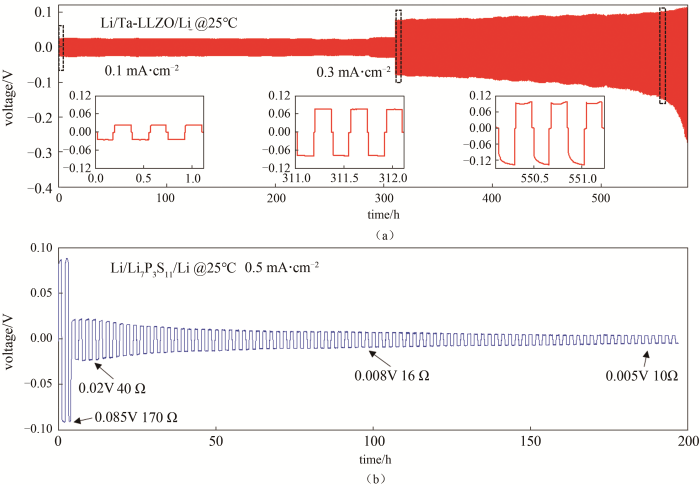
锂/固体电解质/锂对称电池在单次锂溶出-沉积过程中,锂溶出侧与电解质的有效接触趋于变少,锂沉积侧与电解质的有效接触不变或者变多,因此随着锂溶出量的增大,电池内阻上升,电压极化上升,表观在电压-时间曲线上为电压上扬。随着多次锂溶出-沉积,如果没有锂枝晶沿着晶界生长,则电池的内阻越来越大,极化电压越来越高,最终超出保护电压,电池失效。如果有锂枝晶生长,则电池电压突降,短路失效。如图28(a)所示,在0.3 mA/cm2电流密度条件下,Li/LLZTO/Li对称电池的内阻越来越大,极化电压上升。如图28(b)所示,在0.5 mA/cm2电流密度条件下,Li/Li7P3S11/Li对称电池(Li7P3S11由浙江锋锂提供)循环两周后电压从0.085 V骤降至0.02 V,即内阻从170 Ω降低到40 Ω。随着循环时间的延长电解质内部锂枝晶进一步生长,内阻持续降低至10 Ω。
图 28
锂/固体电解质/锂的长循环稳定性与测试电流密度、锂溶出-沉积容量和温度密切相关。电流密度高,锂溶出沉积容量大,对称电池失效越快;温度高,对称电池越定。
6 结语
锂离子固体电解质的离子电导率、电子电导率、电化学窗口、与金属锂的界面稳定性,对固体电解质的开发和机理研究具有重要意义。交流阻抗谱法测量离子电导率的影响因素较多,包括仪器设备、电解质材料体系、阻塞电极材质及状态、电极引线4个重要因素。本文基于实验经验总结了交流阻抗谱法的因素的影响方式,阐述与分析了氧化物、硫化物、聚合物3种类固体电解质的阻塞电极对称电池构建方法和测试实例。旧Hebb-Wagner电池构型和包含锂溶出-沉积峰的循环伏安法测试电化学窗口是不准确的,本文基于文献总结了改进的电池构型和方法,阐述与分析了部分硫化物、氧化物测试实例。锂离子固体电解质与金属锂的界面稳定性是开发高比能固态电池的先决问题,本文基于文献中报道和实验经验总结了改善固固接触的方法和电解质内部锂枝晶短路模型,阐述与分析了极限电流概念和部分硫化物、氧化物测试实例。理论上,本文总结的方法亦适用于其他阳离子固体电解质(如钠离子导体β″-Al2O3和银离子导体AgI)。本文总结的锂离子固体电解质的基础电化学性能测试方法、因素和典型案例尚未经广泛讨论和全面论证,因而期待行业内专家的批评指正。
参考文献
Ionic conductivity of pure and doped Li3N
[J].
The solid electrolyte system, Li3PO4-Li4SiO4
[J].
Electrical conductivity of Li6BeO4-Li5AlO4 solid solutions
[J].
Crystal structure and ionic conductivity of Li14Zn(GeO4)4 and other new Li+ superionic conductors
[J].
The structure of the solid electrolyte LiAgSO4 at 803 K and of LiNaSO4 at 848 K
[J].
Ion diffusion in the high-temperature phases Li2SO4, LiNaSO4, LiAgSO4 and Li4Zn(SO4)3
[J].
Air-stable Li3InCl6 electrolyte with high voltage compatibility for all-solid-state batteries
[J].
Lithium superionic conductors Li3InBr6 and LiInBr4 studied by 7Li, 115In NMR
[J].
Lithium storage in perovskite lithium lanthanum titanate
[J].
Phase stability and transport mechanisms in antiperovskite Li3OCl and Li3OBr superionic conductors
[J].
New lithium-ion conductors based on the NASICON structure
[J].
Fast lithium ion conduction in garnet-type Li7La3Zr2O12
[J].
Lithium garnets: Synthesis, structure, Li+ conductivity, Li+ dynamics and applications
[J].
Preparation of Li2S-P2S5 amorphous solid electrolytes by mechanical milling
[J].
Crystal structure and phase transitions of the lithium ionic conductor Li3PS4
[J].
Crystal structure of a superionic conductor, Li7P3S11
[J].
An iodide-based Li7P2S8I superionic conductor
[J].
Lithium ionic conductor thio-LISICON: The Li2S-GeS2-P2S5 system
[J].
A lithium superionic conductor
[J].
Phase diagramof the Li4GeS4-Li3PS4 quasi-binary system containing the superionic conductor Li10GeP2S12
[J].
High-power all-solid-state batteries using sulfide superionic conductors
[J].
Li6PS5X: A class of crystalline Li-rich solids with an unusually high Li+ mobility
[J].
Formation and conductivity studies of lithium argyrodite solid electrolytes using in-situ neutron diffraction
[J].
Boosting solid-state diffusivity and conductivity in lithium superionic argyrodites by halide substitution
[J].
Pathways for practical high-energy long-cycling lithium metal batteries
[J].
Impedance and modulus spectroscopy of polycrystalline solid electrolytes
[J].
Resolving the grain boundary and lattice impedance of hot-pressed Li7La3Zr2O12 garnet electrolytes
[J].
Oxide electrolytes for lithium batteries
[J].
A hybrid solid electrolyte Li0.33La0.557TiO3/poly(acylonitrile) membrane infiltrated with a succinonitrile-based electrolyte for solid state lithium-ion batteries
[J].
Sulfide solid electrolytes for all-solid-state lithium batteries: Structure, conductivity, stability and application
[J].
Recent advances in solid polymer electrolytes for lithium batteries
[J].
Gel polymer electrolytes for electrochemical energy storage
[J].
Review of the limitation of the Hebb-Wagner polarization method for measuring partial conductivities in mixed ionic electronic conductors
[J].
AC and DC polarization effects in a protonic conductor (borax)
[J].
An investigation of the Hebb-Wagner’s dc polarization technique I. Steady-state chemical potential profiles in solid electrolytes
[J].
Electrochemical stability of Li10GeP2S12 and Li7La3Zr2O12 solid electrolytes
[J].
Superionic conduction and interfacial properties of the low temperature phase Li7P2S8Br0.5I0.5
[J].
Stability of garnet-type Li ion conductors: An overview
[J].
Highly stable garnet solid electrolyte based Li-S battery with modified anodic and cathodic interfaces
[J].
Interfacial phenomena in solid-state lithium battery with sulfide solid electrolyte
[J].
Interface re-engineering of Li10GeP2S12 electrolyte and lithium anode for all-solid-state lithium batteries with ultralong cycle life
[J].
An in-situ element permeation constructed high endurance Li-LLZO interface at high current densities
[J].
Manipulating Li2O atmosphere for sintering dense Li7La3Zr2O12 solid electrolyte
[J].
None-mother-powder method to prepare dense Li-garnet solid electrolytes with high critical current density
[J].