Pathways to low-cost electrochemical energy storage: A comparison of aqueous and nonaqueous flow batteries
4
2014
... 随着液流电池技术的逐步成熟,关键性能指标均已满足大规模储能的要求.经济性较差依旧是液流电池规模推广面临的主要问题.2010年,美国能源部(DOE)高级研究项目能源局(ARPA-E)为储能电池设定了100 $/(kW·h)的目标成本,2015年又把储能系统的目标成本设为100 $/(kW·h)[1].液流电池系统主要由反应堆(板框、电极和膜)、电解液和控制系统组成,其中电解液价格将对液流电池的成本具有决定性影响.液流电池的电解液由活性物质、溶剂和添加剂组成,基于储量丰富的金属或金属化合物的水系电解液在成本控制方面将具有显著优势. ...
... Darling等[1]构建了液流电池的成本模型,分析结果显示:对于工作电压为1.5 V的水系液流电池,其活性物质的成本需要低于5 $/kg才能实现电堆系统120 $/(kW·h)的成本目标.而实际上,目前主流液流电池的活性物质的价格远远高出这一数值[1],如2019年五氧化二钒的平均价格高达24.7 $/kg[2].水系液流电池的电解液成本主要由活性物质的成本决定,而非水系液流电池电解液的成本则由活性物质和有机溶剂的成本组成.虽然非水系电池有电压高、功率密度大的优势,但是有机电解液的成本高且活性物质大多有毒、易燃的缺点在大规模商业化的过程中也将成为瓶颈问题. ...
... [1],如2019年五氧化二钒的平均价格高达24.7 $/kg[2].水系液流电池的电解液成本主要由活性物质的成本决定,而非水系液流电池电解液的成本则由活性物质和有机溶剂的成本组成.虽然非水系电池有电压高、功率密度大的优势,但是有机电解液的成本高且活性物质大多有毒、易燃的缺点在大规模商业化的过程中也将成为瓶颈问题. ...
... Lin等[57]认为,使用Fe(CN)63-/Fe(CN)64-电对取代Br2/Br-电对,是电池正极材料的一种很好的选择.使用2,6-二羟基蒽醌作为负极活性物质,能极大地降低液流电池的成本[1, 58],在pH值大于12的条件下,反应电位与pH无关,电池的开路电压达到1.2 V,室温下电池功率密度达到0.45 W/cm2,电流效率超过99%,能量效率为84%,充放电容量每循环下降0.1%.且采用不同位置羟基取代的蒽醌可以进一步提高电池的电动势,2,3,6,7-四羟基蒽醌与铁氰化物组成的电池电动势达到1.35 V.碱性环境下较低的导电率会导致电压效率较低,尽管电池的高电动势能够部分弥补电阻导致的电压损失,但是仍需进一步提高电解液的导电率.Yuan等[59]也使用Fe(CN)63-/Fe(CN)64-电对作为电池正极,使用Zn(OH)42-/Zn电对作为电池负极,使用带负电的多孔膜解决了锌枝晶容易刺穿膜造成短路的问题,在80 mA/cm2电流密度下,电池电流效率达到99.64%,能量效率为87.72%,且有很好的倍率性能. ...
Performance improvements and cost considerations of the vanadium redox flow battery
1
2019
... Darling等[1]构建了液流电池的成本模型,分析结果显示:对于工作电压为1.5 V的水系液流电池,其活性物质的成本需要低于5 $/kg才能实现电堆系统120 $/(kW·h)的成本目标.而实际上,目前主流液流电池的活性物质的价格远远高出这一数值[1],如2019年五氧化二钒的平均价格高达24.7 $/kg[2].水系液流电池的电解液成本主要由活性物质的成本决定,而非水系液流电池电解液的成本则由活性物质和有机溶剂的成本组成.虽然非水系电池有电压高、功率密度大的优势,但是有机电解液的成本高且活性物质大多有毒、易燃的缺点在大规模商业化的过程中也将成为瓶颈问题. ...
Flow batteries: Current status and trends
1
2015
... 从规模来看,大规模储能所需活性物质的质量将达到百万吨级别以上.从储量及工业规模看,金属元素(诸如铁、铜、锌和铅)及其氧化物、一些通用无机物(如硫酸、盐酸和氢氧化钠)和有机物(如甲醇、乙酸等)已经实现世界范围内的大规模生产[3].因此,要发展低成本大规模储能技术,需要基于水系电解质,并使用诸如铁、铜、锌之类储量丰富的金属元素和基础的无机物盐作为电解质.铁元素作为地球中储量最为丰富的金属元素之一,利用成本低、无毒且环境友好.因此是液流电池十分理想的活性物质的来源,具有显著的成本优势和资源优势,能够满足未来电网级大规模储能的需求.国内外很多学者对铁基液流电池开展了大量的研究工作,对不同铁基电解液存在的科学技术问题进行了分析和讨论,并尝试提出有效的解决方案.本文将对现有铁基液流电池的研究进展进行介绍. ...
lowest cost long-duration storage with no capacity degradation
Aqueous redox transition metal complexes for electrochemical applications as a function of pH
1
1987
... 充电过程,金属铁从Fe(II)溶液中电沉积到负极上,正极则发生Fe(II)被氧化成Fe(III)的反应,放电过程发生逆反应.由于金属铁的析氢过电位较低,所以充电过程中铁电极表面会伴随显著的析氢反应,如式(3)所示,析氢反应会降低电池的电流效率,改变铁电极表面沉积的形貌.而且随着析氢反应的进行,电解液的pH会不断升高导致正极电解液侧铁盐以氢氧化物的形式析出,导致电池容量的持续降低.pH升高后,析氢反应速率会大幅降低,但是在pH提升到能够完全抑制析氢反应的程度前,Fe(II)就已经以氢氧化物的形式析出了,正极侧Fe(III)的析出情况更加严重.因此有学者研究在pH较高、负极析氢反应被较大程度减弱情况下,通过使用铁的络合物来提高正极侧活性物质的溶解度[5].理想的铁的络合物需要满足三个条件:①铁的络合物有较大的溶解度,尤其是在pH=3的条件下;②络合剂本身在电池的电化学窗口中是惰性的;③铁的络合物需要有较快、可逆的反应动力学特性,且能够保证电池的开路电压足够大. ...
Studies of iron-ligand complexes for an all-iron flow battery application
1
2014
... Hawthorne等[6]通过在正极电解液中添加络合剂来抑制三价铁以氢氧化物的形式析出,在开路电势为468 mV(vs. Ag/AgCl),pH=2,甘氨酸和铁比例为1:1条件下,甘氨酸铁与未络合电对有相似的反应动力学特性和扩散系数,在全铁液流电池上有应用前景.但是该研究并没有在实际的全铁液流电池中研究络合物对电池的影响.在另一研究中Hawthorne等[7]发现使用甘氨酸和丙三醇作为配体时,电解液中氯离子在电极上的吸附增强且金属铁沉积变困难,因而降低了铁负极的库仑效率,因此在探索正极铁的络合物时,还需要考虑络合物的存在对负极铁的电沉积产生的影响[8]. ...
An investigation into factors affecting the iron plating reaction for an all-iron flow battery
2
2014
... Hawthorne等[6]通过在正极电解液中添加络合剂来抑制三价铁以氢氧化物的形式析出,在开路电势为468 mV(vs. Ag/AgCl),pH=2,甘氨酸和铁比例为1:1条件下,甘氨酸铁与未络合电对有相似的反应动力学特性和扩散系数,在全铁液流电池上有应用前景.但是该研究并没有在实际的全铁液流电池中研究络合物对电池的影响.在另一研究中Hawthorne等[7]发现使用甘氨酸和丙三醇作为配体时,电解液中氯离子在电极上的吸附增强且金属铁沉积变困难,因而降低了铁负极的库仑效率,因此在探索正极铁的络合物时,还需要考虑络合物的存在对负极铁的电沉积产生的影响[8]. ...
... Hawthorne等[7]通过比较不同阴离子的电解液,发现含有氯离子的电解液比含有硫酸根离子的电解液有更低的析氢速率和更高的电沉积速率;与硫酸根相比,氯离子能够更加紧密的吸附在电极表面,与水和质子竞争反应位点,而且氯离子的脱附需要更负的电位;碘离子和溴离子同样能够吸附在铁表面,且抑制析氢程度比氯离子更高[12-13];在pH=1条件下,氯离子浓度从0.1 mol/L增加5 mol/L,在-0.8 V(vs. Ag/AgCl)电位下,析氢电流降低了95%;此外,由NaCl作为支持电解液的电池中铁电沉积的库仑效率最高,约为97%,高于(NH4)2SO4、KCl和NH4Cl作为支持电解液的电池,且在NaCl和NH4Cl电解液中沉积的铁是稳定的,因此电解液中的阳离子也同样会影响铁负极电沉积的效率. ...
Kinetic regularities governing the reaction of electrodeposition of iron from solutions of citrate complexes of iron(III)
1
2004
... Hawthorne等[6]通过在正极电解液中添加络合剂来抑制三价铁以氢氧化物的形式析出,在开路电势为468 mV(vs. Ag/AgCl),pH=2,甘氨酸和铁比例为1:1条件下,甘氨酸铁与未络合电对有相似的反应动力学特性和扩散系数,在全铁液流电池上有应用前景.但是该研究并没有在实际的全铁液流电池中研究络合物对电池的影响.在另一研究中Hawthorne等[7]发现使用甘氨酸和丙三醇作为配体时,电解液中氯离子在电极上的吸附增强且金属铁沉积变困难,因而降低了铁负极的库仑效率,因此在探索正极铁的络合物时,还需要考虑络合物的存在对负极铁的电沉积产生的影响[8]. ...
Improvements to the coulombic efficiency of the iron electrode for an all-iron redox-flow battery
2
2018
... Jayathilake等[9]在铁电池的负极电解液中添加抗坏血酸,抗坏血酸在铁电极表面的吸附很好地抑制了析氢反应,同时还起到缓冲剂的作用,在高电流密度的情况下,有效减弱电极表面pH的上升,从而减少Fe(OH)2的析出;但是由于抗坏血酸的吸附和抗坏血酸与铁离子的螯合会给铁的氧化还原反应带来一定的阻碍,一定pH下抗坏血酸会降低负极铁的反应速率;此外,Jayathilake等[9]还向负极电解液添加少量氯化镉,镉与铁共沉积之后,在10 mA/cm2电流密度下,析氢过电位增加了1倍,在20 mA/cm2电流密度下,电池的电流效率从90%上升到93%.Manohar等[10]向电解液中加入抗坏血酸,避免铁离子以氢氧化物形式析出并且稳定pH值为2,负极电解液中加入少量氯化铟(0.2 mmol/L)来抑制析氢反应,电流效率达到97%. ...
... [9]还向负极电解液添加少量氯化镉,镉与铁共沉积之后,在10 mA/cm2电流密度下,析氢过电位增加了1倍,在20 mA/cm2电流密度下,电池的电流效率从90%上升到93%.Manohar等[10]向电解液中加入抗坏血酸,避免铁离子以氢氧化物形式析出并且稳定pH值为2,负极电解液中加入少量氯化铟(0.2 mmol/L)来抑制析氢反应,电流效率达到97%. ...
A high efficiency iron-chloride redox flow battery for large-scale energy storage
1
2015
... Jayathilake等[9]在铁电池的负极电解液中添加抗坏血酸,抗坏血酸在铁电极表面的吸附很好地抑制了析氢反应,同时还起到缓冲剂的作用,在高电流密度的情况下,有效减弱电极表面pH的上升,从而减少Fe(OH)2的析出;但是由于抗坏血酸的吸附和抗坏血酸与铁离子的螯合会给铁的氧化还原反应带来一定的阻碍,一定pH下抗坏血酸会降低负极铁的反应速率;此外,Jayathilake等[9]还向负极电解液添加少量氯化镉,镉与铁共沉积之后,在10 mA/cm2电流密度下,析氢过电位增加了1倍,在20 mA/cm2电流密度下,电池的电流效率从90%上升到93%.Manohar等[10]向电解液中加入抗坏血酸,避免铁离子以氢氧化物形式析出并且稳定pH值为2,负极电解液中加入少量氯化铟(0.2 mmol/L)来抑制析氢反应,电流效率达到97%. ...
Investigation of factors affecting performance of the iron-redox battery
1
1981
... 电解液中的阴离子种类对负极铁电沉积的形态和效率有较大影响,且对析氢也会产生影响.Hruska等[11]在1981年首先提出使用铁氧化还原电池作为一种低能量密度的能量储存装置,使用NH4Cl作为支持电解质,电解液的电导率和铁电沉积的质量比使用NaCl或KCl高.铁电极的极化损失可以通过调节电解液的pH来降低,pH值从1上升到3时,电池电压效率从70%上升至83%. ...
Corrosion inhibition of iron in 0.5 mol/L H2SO4 by halide ions
1
2006
... Hawthorne等[7]通过比较不同阴离子的电解液,发现含有氯离子的电解液比含有硫酸根离子的电解液有更低的析氢速率和更高的电沉积速率;与硫酸根相比,氯离子能够更加紧密的吸附在电极表面,与水和质子竞争反应位点,而且氯离子的脱附需要更负的电位;碘离子和溴离子同样能够吸附在铁表面,且抑制析氢程度比氯离子更高[12-13];在pH=1条件下,氯离子浓度从0.1 mol/L增加5 mol/L,在-0.8 V(vs. Ag/AgCl)电位下,析氢电流降低了95%;此外,由NaCl作为支持电解液的电池中铁电沉积的库仑效率最高,约为97%,高于(NH4)2SO4、KCl和NH4Cl作为支持电解液的电池,且在NaCl和NH4Cl电解液中沉积的铁是稳定的,因此电解液中的阳离子也同样会影响铁负极电沉积的效率. ...
The mathematical models of the stripping voltammetry metal deposition/dissolution process
1
2010
... Hawthorne等[7]通过比较不同阴离子的电解液,发现含有氯离子的电解液比含有硫酸根离子的电解液有更低的析氢速率和更高的电沉积速率;与硫酸根相比,氯离子能够更加紧密的吸附在电极表面,与水和质子竞争反应位点,而且氯离子的脱附需要更负的电位;碘离子和溴离子同样能够吸附在铁表面,且抑制析氢程度比氯离子更高[12-13];在pH=1条件下,氯离子浓度从0.1 mol/L增加5 mol/L,在-0.8 V(vs. Ag/AgCl)电位下,析氢电流降低了95%;此外,由NaCl作为支持电解液的电池中铁电沉积的库仑效率最高,约为97%,高于(NH4)2SO4、KCl和NH4Cl作为支持电解液的电池,且在NaCl和NH4Cl电解液中沉积的铁是稳定的,因此电解液中的阳离子也同样会影响铁负极电沉积的效率. ...
Unraveling the viscosity impact on volumetric transfer in redox flow batteries
2020
Effective thermal and electrical conductivity of carbon nanotube composites
1
2007
... 浆料电极是由导电性良好的固体颗粒悬浮在电解液中制成的,浆料可以像全液流电池中的电解液一样通过动力泵泵入电池的正负极.渗透理论指出固体颗粒的体积分数大于某一临界值fc时,浆料将形成连续的导电网络[15],电池的化学反应将在固体悬浮颗粒上发生.对于酸性条件下的全铁浆料电池,金属铁将沉积在导电固体悬浮颗粒上,但是当固体颗粒的体积分数超过另一临界体积分数时,浆料中将没有足够的液体浸润所有颗粒,导致其失去流动性[16-17]. ...
Non-aqueous carbon black suspensions for lithium-based redox flow batteries: Rheology and simultaneous rheo-electrical behavior
1
2013
... 浆料电极是由导电性良好的固体颗粒悬浮在电解液中制成的,浆料可以像全液流电池中的电解液一样通过动力泵泵入电池的正负极.渗透理论指出固体颗粒的体积分数大于某一临界值fc时,浆料将形成连续的导电网络[15],电池的化学反应将在固体悬浮颗粒上发生.对于酸性条件下的全铁浆料电池,金属铁将沉积在导电固体悬浮颗粒上,但是当固体颗粒的体积分数超过另一临界体积分数时,浆料中将没有足够的液体浸润所有颗粒,导致其失去流动性[16-17]. ...
Semi-solid lithium rechargeable flow battery
1
2011
... 浆料电极是由导电性良好的固体颗粒悬浮在电解液中制成的,浆料可以像全液流电池中的电解液一样通过动力泵泵入电池的正负极.渗透理论指出固体颗粒的体积分数大于某一临界值fc时,浆料将形成连续的导电网络[15],电池的化学反应将在固体悬浮颗粒上发生.对于酸性条件下的全铁浆料电池,金属铁将沉积在导电固体悬浮颗粒上,但是当固体颗粒的体积分数超过另一临界体积分数时,浆料中将没有足够的液体浸润所有颗粒,导致其失去流动性[16-17]. ...
Electronic vs ionic limitations to electrochemical performance in Li4Ti5O12-based organic suspensions for lithium-redox flow batteries
1
2014
... 浆料电极的优势在于电极面积与膜面积无关,随浆料量的增加而增加,易生产并可以通过过滤回收.浆料电极在非水锂离子电池[18]和电化学电容器[19]领域中有较多的研究,大多数浆料电极的悬浮颗粒采用高比表面积的碳材料.浆料电池的成本模型指出,考虑到电池的实用性,全铁浆料电池需要在200 mA/cm2电流密度条件下,电压效率达到70%以上[20].同时,电池运行过程中在集流板上的金属铁沉积需少于5%[21].Petek等[21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
Mathematical modeling of electrochemical flow capacitors
1
2015
... 浆料电极的优势在于电极面积与膜面积无关,随浆料量的增加而增加,易生产并可以通过过滤回收.浆料电极在非水锂离子电池[18]和电化学电容器[19]领域中有较多的研究,大多数浆料电极的悬浮颗粒采用高比表面积的碳材料.浆料电池的成本模型指出,考虑到电池的实用性,全铁浆料电池需要在200 mA/cm2电流密度条件下,电压效率达到70%以上[20].同时,电池运行过程中在集流板上的金属铁沉积需少于5%[21].Petek等[21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
Cost and performance model for redox flow batteries
1
2014
... 浆料电极的优势在于电极面积与膜面积无关,随浆料量的增加而增加,易生产并可以通过过滤回收.浆料电极在非水锂离子电池[18]和电化学电容器[19]领域中有较多的研究,大多数浆料电极的悬浮颗粒采用高比表面积的碳材料.浆料电池的成本模型指出,考虑到电池的实用性,全铁浆料电池需要在200 mA/cm2电流密度条件下,电压效率达到70%以上[20].同时,电池运行过程中在集流板上的金属铁沉积需少于5%[21].Petek等[21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
Slurry electrodes for iron plating in an all-iron flow battery
2
2015
... 浆料电极的优势在于电极面积与膜面积无关,随浆料量的增加而增加,易生产并可以通过过滤回收.浆料电极在非水锂离子电池[18]和电化学电容器[19]领域中有较多的研究,大多数浆料电极的悬浮颗粒采用高比表面积的碳材料.浆料电池的成本模型指出,考虑到电池的实用性,全铁浆料电池需要在200 mA/cm2电流密度条件下,电压效率达到70%以上[20].同时,电池运行过程中在集流板上的金属铁沉积需少于5%[21].Petek等[21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
... [21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
Characterizing slurry electrodes using electrochemical impedance spectroscopy
2
2016
... 浆料电极的优势在于电极面积与膜面积无关,随浆料量的增加而增加,易生产并可以通过过滤回收.浆料电极在非水锂离子电池[18]和电化学电容器[19]领域中有较多的研究,大多数浆料电极的悬浮颗粒采用高比表面积的碳材料.浆料电池的成本模型指出,考虑到电池的实用性,全铁浆料电池需要在200 mA/cm2电流密度条件下,电压效率达到70%以上[20].同时,电池运行过程中在集流板上的金属铁沉积需少于5%[21].Petek等[21]使用多壁碳纳米管作为浆料的导电颗粒,发现随着负极浆料的荷电状态(state of charge,SOC)的增加,沉积的金属增多之后,浆料导电性增加,同时,随着部分铁沉积在固体颗粒上,将不再存在碳材料上铁沉积无核的问题,电池的电压效率也有所提高.此外,Petek等[22]使用体积分数为5.8%的多壁碳纳米管作为导电颗粒,浆料电极在200 mA/cm2电流密度下电压效率为82%.浆料电极与充满电解液的石墨毡电极类似,同时存在离子相和电子相,研究发现Fe(III)/Fe(II)电对与碳材料混合成的浆料电极的极化由欧姆极化控制,因此浆料电极技术的关键在于降低电极的电阻[22]. ...
... [22]. ...
Solution redox couples for electrochemical energy storage
1981
Fe(III)/Fe(II) - ligand systems for use as negative half-cells in redox-flow cells
1
1989
... 全液流电池是指正负极的活性物质无论充放电状态都是溶解在电解液中的液流电池.铁离子与螯合剂络合后,反应的平衡电位会发生一定程度的偏移,利用电位偏移方向的不同能将不同Fe(III)/Fe(II)-螯合剂电对分别作为正负极,组成全液流的铁基液流电池.Murthy等[24]发现二乙基三胺五乙酸(DTPA)、氮基三乙酸(NTA)和乙二胺四乙酸(EDTA)与铁离子螯合后,平衡电位均有一定负移,且随着pH上升,螯合物稳定程度会变高,导致电位负移变大,电荷转移速率常数也有一定程度的上升,表现出更好的反应动力学性能;而菲罗啉和联吡啶与铁盐的螯合物会导致反应平衡电位正移,因此认为使用铁的不同螯合物来组成稳定的全铁电池系统是可行的;但是相关研究中没有进行电池性能的测试,虽然电位分别有一定程度的正向和负向移动,但是组成电池的电动势较小.Wen等[25]研究了不同螯合剂对反应动力学性能、溶解度和电化学稳定性的影响.三草酸合铁酸钠、柠檬酸铁和乙二胺四乙酸(EDTA)铁钠电对的平衡电位均向负方向移动.Fe(III)/Fe(II)-EDTA电对反应有较高的反应速率,与Br2/Br-电对组成的电池在三者中有最高的电压效率(86.2%)和能量效率(79.4%),但溶解度较低;三草酸合铁酸钠电对反应是准可逆的,但是电化学稳定性较差,导致与Br2/Br-电对组成的电池容量衰减大;柠檬酸铁的溶解度较高,但是反应动力学性能较差,提高浓度之后,电解液电导率提高,电池性能有相当程度的提升,在0.8 mol/L浓度时电池能量效率达到70%,当浓度超过0.8 mol/L后,电解液的高黏度会导致电解液电阻提高,电池有较大的极化损失. ...
Studies on iron (Fe3+/Fe2+-complex/bromine (Br2/Br-) redox flow cell in sodium acetate solution
1
2006
... 全液流电池是指正负极的活性物质无论充放电状态都是溶解在电解液中的液流电池.铁离子与螯合剂络合后,反应的平衡电位会发生一定程度的偏移,利用电位偏移方向的不同能将不同Fe(III)/Fe(II)-螯合剂电对分别作为正负极,组成全液流的铁基液流电池.Murthy等[24]发现二乙基三胺五乙酸(DTPA)、氮基三乙酸(NTA)和乙二胺四乙酸(EDTA)与铁离子螯合后,平衡电位均有一定负移,且随着pH上升,螯合物稳定程度会变高,导致电位负移变大,电荷转移速率常数也有一定程度的上升,表现出更好的反应动力学性能;而菲罗啉和联吡啶与铁盐的螯合物会导致反应平衡电位正移,因此认为使用铁的不同螯合物来组成稳定的全铁电池系统是可行的;但是相关研究中没有进行电池性能的测试,虽然电位分别有一定程度的正向和负向移动,但是组成电池的电动势较小.Wen等[25]研究了不同螯合剂对反应动力学性能、溶解度和电化学稳定性的影响.三草酸合铁酸钠、柠檬酸铁和乙二胺四乙酸(EDTA)铁钠电对的平衡电位均向负方向移动.Fe(III)/Fe(II)-EDTA电对反应有较高的反应速率,与Br2/Br-电对组成的电池在三者中有最高的电压效率(86.2%)和能量效率(79.4%),但溶解度较低;三草酸合铁酸钠电对反应是准可逆的,但是电化学稳定性较差,导致与Br2/Br-电对组成的电池容量衰减大;柠檬酸铁的溶解度较高,但是反应动力学性能较差,提高浓度之后,电解液电导率提高,电池性能有相当程度的提升,在0.8 mol/L浓度时电池能量效率达到70%,当浓度超过0.8 mol/L后,电解液的高黏度会导致电解液电阻提高,电池有较大的极化损失. ...
Effect of chelation on iron-chromium redox flow batteries
2020
An ultrafast nickel-iron battery from strongly coupled inorganic nanoparticle/nanocarbon hybrid materials
2
2012
... 碱性条件下,铁的化合物Fe3O4或FeOOH作为电池的负极,在充电过程中会依次被还原成Fe(OH)2和单质铁[27-28],放电过程发生逆反应,见式(4)和(5) ...
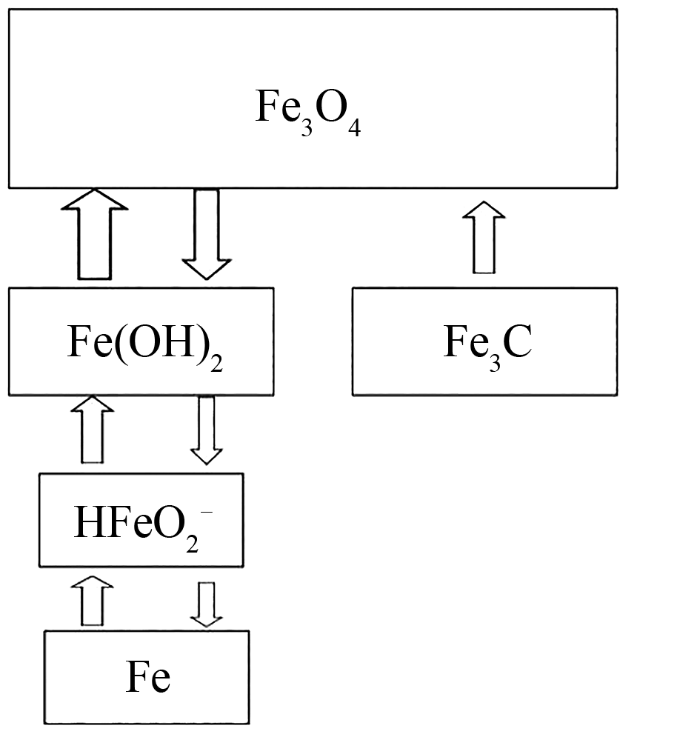
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Developmental studies on porous iron electrodes for the nickel_iron cell
1
1990
... 碱性条件下,铁的化合物Fe3O4或FeOOH作为电池的负极,在充电过程中会依次被还原成Fe(OH)2和单质铁[27-28],放电过程发生逆反应,见式(4)和(5) ...
Triangular potential sweep voltammetric study of porous iron electrodes in alkali solutions
1
1987
... Fe氧化生成Fe(OH)2的反应,一些学者认为涉及到OH-离子吸附的反应,见式(6)和(7)[29-30] ...
The potentiodynamic behaviour of iron in alkaline solutions
2
1979
... Fe氧化生成Fe(OH)2的反应,一些学者认为涉及到OH-离子吸附的反应,见式(6)和(7)[29-30] ...
... 氢原子重组生成氢气的反应被硫离子的化学吸附抑制,同时吸附导致电极表面发生的变化也使析氢反应的过电位增加了[30],减弱了碱性环境下的铁负极的析氢.Hang等[44]发现向电极中加入FeS比向电解液中加入K2S更能够提高电极的容量,这是由于FeS是以固定比例直接加入到电极材料中,硫离子的吸附能力比溶液中的K2S更强,更加容易使氧化层破裂,更大程度地提高电极的导电性. ...
Electrochemical behaviour of pure iron in concentrated sodium hydroxide solutions at different temperatures: A triangular potential sweep voltammetric study
1
1985
... 而大多数学者认为Fe(OH)2的形成是要通过可溶的中间体HFeO2-,见式(8)和(9)[31] ...
镍铁电池的工业应用及最新研究进展
1
2014
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
镍铁电池的工业应用及最新研究进展
1
2014
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Iron/carbon-black composite nanoparticles as an iron electrode material in a paste type rechargeable alkaline battery
1
2010
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Nanostructured Fe3O4/SWNT electrode: Binder-free and high-rate Li-ion anode
1
2010
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Facile scalable synthesis of magnetite nanocrystals embedded in carbon matrix as superior anode materials for lithium-ion batteries
2010
Carbon coated Fe3O4 nanospindles as a superior anode material for lithium-ion batteries
1
2008
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Robust iron nanoparticles with graphitic shells for high-performance Ni-Fe battery
1
2016
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
Electrochemical characteristics of iron carbide as an active material in alkaline batteries
1
2006
... 碱性条件下铁基混合液流电池的铁负极与铁镍电池的负极相似,都是以铁或者铁的氧化物作为负极活性物质,铁的氧化物可以是Fe(OH)2、Fe(OH)3、Fe2O3、Fe3O4、铁粉和羟基铁粉等铁的化合物中的一种或几种,铁电极材料的理论比容量高,但是由于材料自身反应活性较低以及电极制作工艺的限制,工业上铁负极只能达到理论容量的20%~40%[32].Kao等[33]使用硼氢化钠还原铁盐,在40 nm炭黑上还原生成铁单质,电极材料直径在30~80 nm之间,电化学性能优异,能获得600 mA·h/g稳定电池容量.使用纳米级的活性物质能够提高反应活性,但是随着循环进行易发生活性颗粒的聚集长大,炭黑作为连续的导电网络和可溶性中间体的成核芯,能起到防止活性物质聚集长大,保持电池容量稳定的作用,因此在活性物质外包覆导电碳材料是缓解活性物质聚集长大的主要方法[34-36].Wang等[27]研制出使用FeOx/石墨烯复合材料作为电池负极,功率密度比普通铁电极材料提高了近1000倍.Wu等[37]使用石墨碳包覆铁单质,碳能够限制活性物质铁变形,同时也能作为连续导电介质,此复合电极与Ni(OH)2组成的电池能够获得高倍率性能和较强的循环稳定性.Ujimine等[38]研究了Fe3C作为碱性电池阳极在充放电过程中的电化学性能,Fe3C作为电极材料比纯铁更加经济.Fe3C在放电过程中被氧化为Fe3O4,这一过程是不可逆的,充电过程中Fe3O4被依次还原成Fe(OH)2和Fe,这是可逆过程,反应过程如图2所示;充放电测试后观察到活性物质颗粒的直径更加小且形状更加圆润,证实了Fe(OH)2和Fe的转化要通过可溶的中间物质HFeO2-.测试过程中铁电极上发生了不可忽略的钝化,钝化是由于铁的氢氧化物层的低导电性,导致电极容量明显下降,因此铁负极的钝化问题需要进一步的研究和改善. ...
An aqueous alkaline battery consisting of inexpensive all-iron redox chemistries for large-scale energy storage
1
2018
... Wei等[39]提出了一个碱性环境下的全铁半液流电池,该全铁电池成本只需要22 $/(kW·h),比全钒液流电池[118 $/(kW·h)]和铁镍电池[51 $/(kW·h)]都低很多[40].电池充电过程中,负极发生式(4)和式(5)的还原反应,正极发生式(10)的氧化反应,放电过程发生逆反应.正极活性物质黄血盐是一种食品添加剂,无挥发性和腐蚀性,且通过阳离子交换膜的交叉渗透极小,氧化还原反应高度可逆.制作全铁电池负极的关键在于提高电极中Fe3O4/Fe的反应活性和活性物质的利用率,研究中将商业购买的Fe3O4纳米颗粒、炭黑和PTFE悬浮液以一定比例混合配置成浆料涂覆在泡沫镍上后压制成电极.此电池电流效率达到99%以上,在2 mA/cm2电流密度下能量效率达到76%,每循环容量衰减为0.15%.但是当增加电流密度至6 mA/cm2时,此电池的能量效率降低至56%,这是由电池极化随电流密度升高不断加强导致的. ...
A high-energy and low-cost polysulfide/iodide redox flow battery
1
2016
... Wei等[39]提出了一个碱性环境下的全铁半液流电池,该全铁电池成本只需要22 $/(kW·h),比全钒液流电池[118 $/(kW·h)]和铁镍电池[51 $/(kW·h)]都低很多[40].电池充电过程中,负极发生式(4)和式(5)的还原反应,正极发生式(10)的氧化反应,放电过程发生逆反应.正极活性物质黄血盐是一种食品添加剂,无挥发性和腐蚀性,且通过阳离子交换膜的交叉渗透极小,氧化还原反应高度可逆.制作全铁电池负极的关键在于提高电极中Fe3O4/Fe的反应活性和活性物质的利用率,研究中将商业购买的Fe3O4纳米颗粒、炭黑和PTFE悬浮液以一定比例混合配置成浆料涂覆在泡沫镍上后压制成电极.此电池电流效率达到99%以上,在2 mA/cm2电流密度下能量效率达到76%,每循环容量衰减为0.15%.但是当增加电流密度至6 mA/cm2时,此电池的能量效率降低至56%,这是由电池极化随电流密度升高不断加强导致的. ...
Carbon aerogel modified graphite felt as advanced electrodes for vanadium redox flow batteries
1
2019
... 电池的内阻较高,导致电流密度上升时,电压效率降低,因此需要增大活性物质与电解液的接触面积,并可以尝试与比表面积更大的碳材料结合,降低电池内阻[41],使用粒径更小的活性物质,提高反应活性[42],提高活性物质的利用率[43].Hang等[44]将铁粉、不同种类的碳材料和PTFE悬浮液以固定比例混合轧制成电极,碳材料分别为碳纤维、乙炔黑、石墨和碳纳米纤维;使用碳纳米纤维对电极容量的提升作用比普通碳材料更显著,因为碳纳米纤维有更大的比表面积,通过可溶性中间产物HFeO2-形成的Fe(OH)2层更加薄,更容易氧化为Fe(III).氧化还原液流电池中,电流效率与活性物质通过膜的渗透、正负极的副反应和旁路电流有关,酸性环境下活性物质大多带正电或中性,渗透的问题对电流效率的影响较大,而碱性环境下活性物质大多带负电,通过膜的交叉渗透很小,几乎可以忽略[45]. ...
Engineering aspects of the design, construction and performance of modular redox flow batteries for energy storage
1
2017
... 电池的内阻较高,导致电流密度上升时,电压效率降低,因此需要增大活性物质与电解液的接触面积,并可以尝试与比表面积更大的碳材料结合,降低电池内阻[41],使用粒径更小的活性物质,提高反应活性[42],提高活性物质的利用率[43].Hang等[44]将铁粉、不同种类的碳材料和PTFE悬浮液以固定比例混合轧制成电极,碳材料分别为碳纤维、乙炔黑、石墨和碳纳米纤维;使用碳纳米纤维对电极容量的提升作用比普通碳材料更显著,因为碳纳米纤维有更大的比表面积,通过可溶性中间产物HFeO2-形成的Fe(OH)2层更加薄,更容易氧化为Fe(III).氧化还原液流电池中,电流效率与活性物质通过膜的渗透、正负极的副反应和旁路电流有关,酸性环境下活性物质大多带正电或中性,渗透的问题对电流效率的影响较大,而碱性环境下活性物质大多带负电,通过膜的交叉渗透很小,几乎可以忽略[45]. ...
Evolution of useless iron rust into uniform α-Fe2O3 nanospheres: A smart way to make sustainable anodes for hybrid Ni-Fe cell devices
1
2016
... 电池的内阻较高,导致电流密度上升时,电压效率降低,因此需要增大活性物质与电解液的接触面积,并可以尝试与比表面积更大的碳材料结合,降低电池内阻[41],使用粒径更小的活性物质,提高反应活性[42],提高活性物质的利用率[43].Hang等[44]将铁粉、不同种类的碳材料和PTFE悬浮液以固定比例混合轧制成电极,碳材料分别为碳纤维、乙炔黑、石墨和碳纳米纤维;使用碳纳米纤维对电极容量的提升作用比普通碳材料更显著,因为碳纳米纤维有更大的比表面积,通过可溶性中间产物HFeO2-形成的Fe(OH)2层更加薄,更容易氧化为Fe(III).氧化还原液流电池中,电流效率与活性物质通过膜的渗透、正负极的副反应和旁路电流有关,酸性环境下活性物质大多带正电或中性,渗透的问题对电流效率的影响较大,而碱性环境下活性物质大多带负电,通过膜的交叉渗透很小,几乎可以忽略[45]. ...
The effect of additives on the electrochemical properties of Fe/C composite for Fe/air battery anode
2
2006
... 电池的内阻较高,导致电流密度上升时,电压效率降低,因此需要增大活性物质与电解液的接触面积,并可以尝试与比表面积更大的碳材料结合,降低电池内阻[41],使用粒径更小的活性物质,提高反应活性[42],提高活性物质的利用率[43].Hang等[44]将铁粉、不同种类的碳材料和PTFE悬浮液以固定比例混合轧制成电极,碳材料分别为碳纤维、乙炔黑、石墨和碳纳米纤维;使用碳纳米纤维对电极容量的提升作用比普通碳材料更显著,因为碳纳米纤维有更大的比表面积,通过可溶性中间产物HFeO2-形成的Fe(OH)2层更加薄,更容易氧化为Fe(III).氧化还原液流电池中,电流效率与活性物质通过膜的渗透、正负极的副反应和旁路电流有关,酸性环境下活性物质大多带正电或中性,渗透的问题对电流效率的影响较大,而碱性环境下活性物质大多带负电,通过膜的交叉渗透很小,几乎可以忽略[45]. ...
... 氢原子重组生成氢气的反应被硫离子的化学吸附抑制,同时吸附导致电极表面发生的变化也使析氢反应的过电位增加了[30],减弱了碱性环境下的铁负极的析氢.Hang等[44]发现向电极中加入FeS比向电解液中加入K2S更能够提高电极的容量,这是由于FeS是以固定比例直接加入到电极材料中,硫离子的吸附能力比溶液中的K2S更强,更加容易使氧化层破裂,更大程度地提高电极的导电性. ...
Progress in flow battery research and development
1
2011
... 电池的内阻较高,导致电流密度上升时,电压效率降低,因此需要增大活性物质与电解液的接触面积,并可以尝试与比表面积更大的碳材料结合,降低电池内阻[41],使用粒径更小的活性物质,提高反应活性[42],提高活性物质的利用率[43].Hang等[44]将铁粉、不同种类的碳材料和PTFE悬浮液以固定比例混合轧制成电极,碳材料分别为碳纤维、乙炔黑、石墨和碳纳米纤维;使用碳纳米纤维对电极容量的提升作用比普通碳材料更显著,因为碳纳米纤维有更大的比表面积,通过可溶性中间产物HFeO2-形成的Fe(OH)2层更加薄,更容易氧化为Fe(III).氧化还原液流电池中,电流效率与活性物质通过膜的渗透、正负极的副反应和旁路电流有关,酸性环境下活性物质大多带正电或中性,渗透的问题对电流效率的影响较大,而碱性环境下活性物质大多带负电,通过膜的交叉渗透很小,几乎可以忽略[45]. ...
Rechargeable alkaline iron electrodes
1
1991
... 通过向电解液中加入添加剂来抑制析氢和提高电极的循环稳定性,与铁电极具体反应过程密切相关,研究表明硫化物能够减轻电极的钝化并且能够提高电极高倍率下的放电性能:硫离子能够对铁的氢氧化物膜产生作用,增加氢氧化物膜中的缺陷,提高钝化层的导电性[46];硫离子与电极氧化层中存在的Fe(Ⅰ)、Fe(Ⅱ)和Fe(Ⅲ)相互作用,使氧化层破裂,促使更多电极中的铁氧化成Fe(Ⅱ)和Fe(Ⅲ),提升电极的容量,硫离子对Fe3O4膜的作用较小,但是Fe3O4本身有一定导电性,对电极性能影响较小[47];电极表面的吸附作用能够使硫离子进入晶格,从而使电极表面形态发生变化,提高活性面积[48].之所以能够抑制析氢是由于添加剂中的硫离子能吸附在电极表面,而电极上发生析氢反应主要有两种路径[49],如式(12)和(13)所示 ...
The role of FeS and (NH4)2CO3 additives on the pressed type Fe electrode
1
1998
... 通过向电解液中加入添加剂来抑制析氢和提高电极的循环稳定性,与铁电极具体反应过程密切相关,研究表明硫化物能够减轻电极的钝化并且能够提高电极高倍率下的放电性能:硫离子能够对铁的氢氧化物膜产生作用,增加氢氧化物膜中的缺陷,提高钝化层的导电性[46];硫离子与电极氧化层中存在的Fe(Ⅰ)、Fe(Ⅱ)和Fe(Ⅲ)相互作用,使氧化层破裂,促使更多电极中的铁氧化成Fe(Ⅱ)和Fe(Ⅲ),提升电极的容量,硫离子对Fe3O4膜的作用较小,但是Fe3O4本身有一定导电性,对电极性能影响较小[47];电极表面的吸附作用能够使硫离子进入晶格,从而使电极表面形态发生变化,提高活性面积[48].之所以能够抑制析氢是由于添加剂中的硫离子能吸附在电极表面,而电极上发生析氢反应主要有两种路径[49],如式(12)和(13)所示 ...
Role of sulphide additives on the performance of alkaline iron electrodes
1
1990
... 通过向电解液中加入添加剂来抑制析氢和提高电极的循环稳定性,与铁电极具体反应过程密切相关,研究表明硫化物能够减轻电极的钝化并且能够提高电极高倍率下的放电性能:硫离子能够对铁的氢氧化物膜产生作用,增加氢氧化物膜中的缺陷,提高钝化层的导电性[46];硫离子与电极氧化层中存在的Fe(Ⅰ)、Fe(Ⅱ)和Fe(Ⅲ)相互作用,使氧化层破裂,促使更多电极中的铁氧化成Fe(Ⅱ)和Fe(Ⅲ),提升电极的容量,硫离子对Fe3O4膜的作用较小,但是Fe3O4本身有一定导电性,对电极性能影响较小[47];电极表面的吸附作用能够使硫离子进入晶格,从而使电极表面形态发生变化,提高活性面积[48].之所以能够抑制析氢是由于添加剂中的硫离子能吸附在电极表面,而电极上发生析氢反应主要有两种路径[49],如式(12)和(13)所示 ...
The influence of sulphide environment on hydrogen evolution at a stainless steel cathode in alkaline solution
1
1988
... 通过向电解液中加入添加剂来抑制析氢和提高电极的循环稳定性,与铁电极具体反应过程密切相关,研究表明硫化物能够减轻电极的钝化并且能够提高电极高倍率下的放电性能:硫离子能够对铁的氢氧化物膜产生作用,增加氢氧化物膜中的缺陷,提高钝化层的导电性[46];硫离子与电极氧化层中存在的Fe(Ⅰ)、Fe(Ⅱ)和Fe(Ⅲ)相互作用,使氧化层破裂,促使更多电极中的铁氧化成Fe(Ⅱ)和Fe(Ⅲ),提升电极的容量,硫离子对Fe3O4膜的作用较小,但是Fe3O4本身有一定导电性,对电极性能影响较小[47];电极表面的吸附作用能够使硫离子进入晶格,从而使电极表面形态发生变化,提高活性面积[48].之所以能够抑制析氢是由于添加剂中的硫离子能吸附在电极表面,而电极上发生析氢反应主要有两种路径[49],如式(12)和(13)所示 ...
A high-performance rechargeable iron electrode for large-scale battery-based energy storage
1
2012
... Manohar等[50]往电极中加入Bi2S3后,充电过程Bi2S3会发生式(14)的还原反应,由于Bi被还原的电位比铁电极的电位正,Bi2S3先被还原成金属Bi,金属Bi的高析氢过电位极大地抑制了电极的析氢,且放电过程中不会达到金属Bi被氧化的电位,故金属Bi能稳定地抑制电极的析氢.电极中还原硫化铋得到的硫离子与Fe(OH)2反应生成FeS[式(15)],铁的硫化物与硫离子作用生成多种价态的铁硫化物,解决了放电生成绝缘的Fe(OH)2的问题,电池能够在高倍率放电的同时获得较高的比容量. ...
Enhancing the performance of the rechargeable iron electrode in alkaline batteries with bismuth oxide and iron sulfide additives
1
2013
... 电极中加入氧化铋也能一定程度抑制析氢反应的进行,由于还原生成的金属铋形态不同导致析氢电流仍然比加入Bi2S3大60%[51],电极中氧化铋主要发生式(16)的反应. ...
The role of hydrogen in metal electrodeposition processes
1
1997
... 诸如铂和镍这类d轨道不被电子全部占满的金属有较强的氢化学吸附作用,从而导致很低的析氢过电位,相反d轨道被电子占满的锌、铅、铋和汞则有较高的析氢过电位[52],因此电解液中添加能与铁共沉积的金属盐,可以抑制铁电极上的析氢反应,但是为发展无毒环保的电池,可以尝试锡、铋之类的金属;同样拥有高析氢过电位的金属还有镉、铅、铟和汞等,但是与铋相比都有较高的毒性,不适合用作大规模储能电池的添加物. ...
Organo-sulfur molecules enable iron-based battery electrodes to meet the challenges of large-scale electrical energy storage
1
2014
... 同样利用含硫物质的吸附来提高析氢过电位,Yang等[53]向电解液中添加含硫的有机化合物,通过有机硫化物在铁电极的吸附来减弱析氢,同时有机硫化物在铁电极的强吸附导致一些硫元素融进铁电极,即发生式(17)的反应,生成铁的硫化物,缓解电极Fe(OH)2层的绝缘性,提高了电极的倍率性能.长链硫醇能够形成紧密的自组装吸附层,析氢速率比购买的商业电极降低80%.二硫醇、硫醚和芳香硫醇的抑制效果也不错,但弱于长链硫醇.紧密吸附的有机硫化物不容易在电极反应过程中被氧化,稳定性优异.Souradip等[54]在电解液中少量加入直链硫醇,能够在铁电极表面组成自组装的单层,硫醇分子外侧的疏水基团起到隔离水的作用,减少了能接触到电极表面的水,降低了析氢反应速率.直链硫醇直链碳原子数大于6时,析氢反应速率能够降低90%. ...
Self-assembled monolayers of n-alkanethiols suppress hydrogen evolution and increase the efficiency of rechargeable iron battery electrodes
1
2013
... 同样利用含硫物质的吸附来提高析氢过电位,Yang等[53]向电解液中添加含硫的有机化合物,通过有机硫化物在铁电极的吸附来减弱析氢,同时有机硫化物在铁电极的强吸附导致一些硫元素融进铁电极,即发生式(17)的反应,生成铁的硫化物,缓解电极Fe(OH)2层的绝缘性,提高了电极的倍率性能.长链硫醇能够形成紧密的自组装吸附层,析氢速率比购买的商业电极降低80%.二硫醇、硫醚和芳香硫醇的抑制效果也不错,但弱于长链硫醇.紧密吸附的有机硫化物不容易在电极反应过程中被氧化,稳定性优异.Souradip等[54]在电解液中少量加入直链硫醇,能够在铁电极表面组成自组装的单层,硫醇分子外侧的疏水基团起到隔离水的作用,减少了能接触到电极表面的水,降低了析氢反应速率.直链硫醇直链碳原子数大于6时,析氢反应速率能够降低90%. ...
A study of the Fe(III)/Fe(II)-triethanolamine complex redox couple for redox flow battery application
1
2006
... Wen等[55]对碱性环境下铁螯合物的电化学性能进行研究,发现Fe(III)/Fe(II)-三乙醇胺(TEOA)螯合物电对在碱性环境中平衡电位很负,达到-1.04 V(vs. SCE),能与Br2/Br-组成电动势约为2.0 V的电池,远高于全钒液流电池的电动势1.3 V.通过提高电解液中TEOA的浓度,能够提高Fe(III)-TEOA螯合物的溶解度,可以达到0.6 mol/L.电池中螯合物的浓度会影响电池性能,浓度大于0.5 mol/L会导致电解液黏度增大导电性降低,浓度过低会导致较高的浓差极化损失;当螯合物浓度为0.4 mol/L,电流密度为20 mA/cm2时,电池开路电压为2.0 V,电压效率为84%,能量效率为70%. ...
All-soluble all-iron aqueous redox-flow battery
1
2016
... Gong等[56]将Fe(III)/Fe(II)-三乙醇胺(TEOA)电对与Fe(CN)63-/Fe(CN)64-电对组成电池,首次提出碱性环境下的全铁液流电池,正负极反应为式(18)和式(10),正极电对的电极电势在0.5 mol/L离子浓度下能达到0.44 V(vs. SHE),电池电压为1.34 V;且螯合物电对反应的标准速率常数高于电对Fe3+/Fe2+;电池在40 mA/cm2电流密度下电池电流效率为93%,能量效率为73%,峰值功率密度为160 mW/cm2;能量效率较低主要是由于溶液中自由存在的TEOA对膜的污染导致膜的电阻变大,降低了电压效率,同时交叉渗透的TEOA会被正极的Fe(CN)63-氧化,降低电池的电流效率,因此该碱性全铁液流电池技术的关键在于耐TEOA膜的研发. ...
Alkaline quinone flow battery
1
2015
... Lin等[57]认为,使用Fe(CN)63-/Fe(CN)64-电对取代Br2/Br-电对,是电池正极材料的一种很好的选择.使用2,6-二羟基蒽醌作为负极活性物质,能极大地降低液流电池的成本[1, 58],在pH值大于12的条件下,反应电位与pH无关,电池的开路电压达到1.2 V,室温下电池功率密度达到0.45 W/cm2,电流效率超过99%,能量效率为84%,充放电容量每循环下降0.1%.且采用不同位置羟基取代的蒽醌可以进一步提高电池的电动势,2,3,6,7-四羟基蒽醌与铁氰化物组成的电池电动势达到1.35 V.碱性环境下较低的导电率会导致电压效率较低,尽管电池的高电动势能够部分弥补电阻导致的电压损失,但是仍需进一步提高电解液的导电率.Yuan等[59]也使用Fe(CN)63-/Fe(CN)64-电对作为电池正极,使用Zn(OH)42-/Zn电对作为电池负极,使用带负电的多孔膜解决了锌枝晶容易刺穿膜造成短路的问题,在80 mA/cm2电流密度下,电池电流效率达到99.64%,能量效率为87.72%,且有很好的倍率性能. ...
A metal-free organic-inorganic aqueous flow battery
1
2014
... Lin等[57]认为,使用Fe(CN)63-/Fe(CN)64-电对取代Br2/Br-电对,是电池正极材料的一种很好的选择.使用2,6-二羟基蒽醌作为负极活性物质,能极大地降低液流电池的成本[1, 58],在pH值大于12的条件下,反应电位与pH无关,电池的开路电压达到1.2 V,室温下电池功率密度达到0.45 W/cm2,电流效率超过99%,能量效率为84%,充放电容量每循环下降0.1%.且采用不同位置羟基取代的蒽醌可以进一步提高电池的电动势,2,3,6,7-四羟基蒽醌与铁氰化物组成的电池电动势达到1.35 V.碱性环境下较低的导电率会导致电压效率较低,尽管电池的高电动势能够部分弥补电阻导致的电压损失,但是仍需进一步提高电解液的导电率.Yuan等[59]也使用Fe(CN)63-/Fe(CN)64-电对作为电池正极,使用Zn(OH)42-/Zn电对作为电池负极,使用带负电的多孔膜解决了锌枝晶容易刺穿膜造成短路的问题,在80 mA/cm2电流密度下,电池电流效率达到99.64%,能量效率为87.72%,且有很好的倍率性能. ...
Negatively charged nanoporous membrane for a dendrite-free alkaline zinc-based flow battery with long cycle life
1
2018
... Lin等[57]认为,使用Fe(CN)63-/Fe(CN)64-电对取代Br2/Br-电对,是电池正极材料的一种很好的选择.使用2,6-二羟基蒽醌作为负极活性物质,能极大地降低液流电池的成本[1, 58],在pH值大于12的条件下,反应电位与pH无关,电池的开路电压达到1.2 V,室温下电池功率密度达到0.45 W/cm2,电流效率超过99%,能量效率为84%,充放电容量每循环下降0.1%.且采用不同位置羟基取代的蒽醌可以进一步提高电池的电动势,2,3,6,7-四羟基蒽醌与铁氰化物组成的电池电动势达到1.35 V.碱性环境下较低的导电率会导致电压效率较低,尽管电池的高电动势能够部分弥补电阻导致的电压损失,但是仍需进一步提高电解液的导电率.Yuan等[59]也使用Fe(CN)63-/Fe(CN)64-电对作为电池正极,使用Zn(OH)42-/Zn电对作为电池负极,使用带负电的多孔膜解决了锌枝晶容易刺穿膜造成短路的问题,在80 mA/cm2电流密度下,电池电流效率达到99.64%,能量效率为87.72%,且有很好的倍率性能. ...
Transport properties of carbon dioxide through amine functionalized carrier membranes
1
1995
... 可以看到,铁氰化钾/亚铁氰化钾电对由于其稳定、反应高度可逆且易获取的优点,与许多电对在碱性环境中组成了电池,且应用会越来越广泛;使用铁的螯合物作为活性材料需要解决溶解度较低的问题,较低的溶解度会导致电池容量较低,还会在高电流密度的情况下产生较高的极化损失;同时,螯合剂对于膜会产生污染,阳离子交换膜对烷基胺有一定的吸收作用[60-61],Nafion膜会吸附三乙醇胺,导致质子交换膜被污染,提高了膜的电阻,因此开发耐TEOA膜是使用Fe(III)/Fe(II)-三乙醇胺作为电池负极的关键. ...
Transport mechanism of carbon dioxide through perfluorosulfonate ionomer membranes containing an amine carrier
1
1996
... 可以看到,铁氰化钾/亚铁氰化钾电对由于其稳定、反应高度可逆且易获取的优点,与许多电对在碱性环境中组成了电池,且应用会越来越广泛;使用铁的螯合物作为活性材料需要解决溶解度较低的问题,较低的溶解度会导致电池容量较低,还会在高电流密度的情况下产生较高的极化损失;同时,螯合剂对于膜会产生污染,阳离子交换膜对烷基胺有一定的吸收作用[60-61],Nafion膜会吸附三乙醇胺,导致质子交换膜被污染,提高了膜的电阻,因此开发耐TEOA膜是使用Fe(III)/Fe(II)-三乙醇胺作为电池负极的关键. ...