[1]
LARCHER D, TARASCON J M. Towards greener and more sustainable batteries for electrical energy storage[J]. Nature Chemistry, 2015, 7(1): 19-29.
[本文引用: 1]
[2]
DUNN B, KAMATH H, TARASCON J M. Electrical energy storage for the grid: A battery of choices[J]. Science, 2011, 334(6058): 928-935.
[本文引用: 2]
[3]
HITTINGER E, CIEZ R E. Modeling costs and benefits of energy storage systems[J]. Annual Review of Environment and Resources, 2020, 45: 445-469.
[本文引用: 1]
[4]
LIU J, BAO Z N, CUI Y, et al. Pathways for practical high-energy long-cycling lithium metal batteries[J]. Nature Energy, 2019, 4(3): 180-186.
[本文引用: 1]
[5]
AL SHAQSI A Z, SOPIAN K, AL-HINAI A. Review of energy storage services, applications, limitations, and benefits[J]. Energy Reports, 2020, 6: 288-306.
[本文引用: 1]
[6]
彭林峰, 贾欢欢, 丁庆, 等. 基于无机钠离子导体的固态钠电池研究进展[J]. 储能科学与技术, 2020, 9(5): 1370-1382.
[本文引用: 1]
PENG L F, JIA H H, DING Q, et al. Research progress of solid-state sodium batteries using inorganic sodium ion conductors[J]. Energy Storage Science and Technology, 2020, 9(5): 1370-1382.
[本文引用: 1]
[7]
YUNG-FANG YU YAO, KUMMER J T. Ion exchange properties of and rates of ionic diffusion in beta-alumina[J]. Journal of Inorganic and Nuclear Chemistry, 1967, 29(9): 2453-2475.
[本文引用: 2]
[8]
HOU W R, GUO X W, SHEN X Y, et al. Solid electrolytes and interfaces in all-solid-state sodium batteries: Progress and perspective[J]. Nano Energy, 2018, 52: 279-291.
[本文引用: 2]
[9]
OSHIMA T, KAJITA M, OKUNO A. Development of sodium-sulfur batteries[J]. International Journal of Applied Ceramic Technology, 2005, 1(3): 269-276.
[本文引用: 1]
[10]
CHEN G, LU J, ZHOU X, et al. Solid-state synthesis of high performance Na-β″-Al2 O3 solid electrolyte doped with MgO[J]. Ceram Int, 2016, 42 (14): 16055-16062.
[本文引用: 2]
[11]
YI E, TEMECHE E, LAINE R M. Superionically conducting β"-Al2 O3 thin films processed using flame synthesized nanopowders[J]. Journal of Materials Chemistry A, 2018, 6(26): 12411-12419.
[本文引用: 2]
[12]
LEE S T, LEE D H, KIM J S, et al. Influence of Fe and Ti addition on properties of Na+ -β/β"-alumina solid electrolytes[J]. Metals and Materials International, 2017, 23(2): 246-253.
[本文引用: 2]
[13]
XU D, JIANG H, LI Y, et al. The mechanical and electrical properties of Nb2 O5 doped Na-β″-Al2 O3 solid electrolyte[J]. The European Physical Journal Applied Physics, 2016, 74(1): 10901.
[本文引用: 2]
[14]
HONG Y F, HUANG P, ZHU C F. Synthesis and characterization of NiO doped beta-Al2 O3 solid electrolyte[J]. Journal of Alloys and Compounds, 2016, 688: 746-751.
[本文引用: 2]
[15]
GOODENOUGH J B, HONG H Y P, KAFALAS J A. Fast Na+ -ion transport in skeleton structures[J]. Materials Research Bulletin, 1976, 11(2): 203-220.
[本文引用: 1]
[16]
ZHAO C L, LIU L L, QI X G, et al. Solid-state sodium batteries[J]. Advanced Energy Materials, 2018, 8(17): 1703012.
[本文引用: 2]
[17]
MA Q, GUIN M, NAQASH S, et al. Scandium-substituted Na3 Zr2 (SiO4 )2 (PO4 ) prepared by a solution-assisted solid-state reaction method as sodium-ion conductors[J]. Chemistry of Materials, 2016, 28 (13): 4821-4828.
[本文引用: 2]
[18]
SONG S, DUONG H M, KORSUNSKY A M, et al. A Na+ superionic conductor for room-temperature sodium batteries[J]. Scientific Reports, 2016, 6(1): 1-10.
[本文引用: 2]
[19]
ZHANG Z, ZHANG Q, SHI J, et al. A self-forming composite electrolyte for solid-state sodium battery with ultralong cycle life[J]. Advanced Energy Materials, 2017, 7 (4): 1601196.
[本文引用: 2]
[20]
KHAKPOUR Z. Influence of M: Ce4+ , Gd3+ and Yb3+ substituted Na3+ x Zr2 -x Mx Si2 PO12 solid NASICON electrolytes on sintering, microstructure and conductivity[J]. Electrochimica Acta, 2016, 196: 337-347.
[本文引用: 1]
[21]
YANG J, LIU G, AVDEEV M, et al. Ultrastable all-solid-state sodium rechargeable batteries[J]. ACS Energy Letters, 2020, 5 (9): 2835-2841.
[本文引用: 2]
[22]
LI C, LI R, LIU K N, et al. NaSICON: A promising solid electrolyte for solid-state sodium batteries[J]. Interdisciplinary Materials, 2022, 1(3): 396-416.
[本文引用: 1]
[23]
SHEN L, DENG S G, JIANG R R, et al. Flexible composite solid electrolyte with 80 wt% Na3.4 Zr1.9 Zn0.1 Si2.2 P0.8 O12 for solid-state sodium batteries[J]. Energy Storage Materials, 2022, 46: 175-181.
[本文引用: 1]
[24]
CAI S, TIAN H Q, LIU J H, et al. Tuning Na3 Hf2 Si2 PO12 electrolyte surfaces by metal coating for high-rate and long cycle life solid-state sodium ion batteries[J]. Journal of Materials Chemistry A, 2022, 10(3): 1284-1289.
[本文引用: 1]
[25]
SESSA S D, PALONE F, NECCI A, et al. Sodium-nickel chloride battery experimental transient modelling for energy stationary storage[J]. Journal of Energy Storage, 2017, 9: 40-46.
[本文引用: 1]
[26]
胡英瑛, 吴相伟, 温兆银, 等. 储能钠电池技术发展的挑战与思考[J]. 中国工程科学, 2021, 23(5): 94-102.
[本文引用: 1]
HU Y Y, WU X W, WEN Z Y, et al. Challenges and thoughts on the development of sodium battery technology for energy storage[J]. Strategic Study of CAE, 2021, 23(5): 94-102.
[本文引用: 1]
[27]
李伟峰, 马素花, 沈晓冬, 等. 面向大规模电网储能的钠基电池研究进展[J]. 电源技术, 2015, 39(1): 213-216.
[本文引用: 1]
LI W F, MA S H, SHEN X D, et al. Advances of sodium based batteries for large-scale energy storage of power grid[J]. Chinese Journal of Power Sources, 2015, 39(1): 213-216.
[本文引用: 1]
[28]
ANDRIOLLO M, BENATO R, DAMBONE SESSA S, et al. Energy intensive electrochemical storage in Italy: 34.8 MW sodium-sulphur secondary cells[J]. Journal of Energy Storage, 2016, 5: 146-155.
[本文引用: 1]
[29]
VISWANATHAN L, IKUMA Y, VIRKAR A V. Transfomation toughening of β"-alumina by incorporation of zirconia[J]. Journal of Materials Science, 1983, 18(1): 109-113.
[本文引用: 1]
[30]
LIU L, MAEDA K, ONDA T, et al. Microstructure and improved mechanical properties of Al2 O3 /Ba-β-Al2 O3 /ZrO2 composites with YSZ addition[J]. Journal of the European Ceramic Society, 2018, 38(15): 5113-5121.
[本文引用: 1]
[31]
LIU L, MAEDA K, ONDA T, et al. Effect of YSZ with different Y2 O3 contents on toughening behavior of Al2 O3 /Ba-β-Al2 O3 /ZrO2 composites[J]. Ceramics International, 2019, 45(14): 18037-18043.
[本文引用: 1]
[32]
LEE D H, LEE D G, LIM S K. Influence of MnO2 and Ta2 O5 /YSZ addition on properties of Na+ -β/β"-alumina solid electrolytes prepared by a synthesizing-cum-sintering process[J]. Ceramics International, 2021, 47(17): 24743-24751.
[本文引用: 1]
[33]
ANSELL R. The chemical and electrochemical stability of beta-alumina[J]. Journal of Materials Science, 1986, 21(2): 365-379.
[本文引用: 1]
[34]
HU Y Y, WEN Z Y, WU X W, et al. Low-cost shape-control synthesis of porous carbon film on β"-alumina ceramics for Na-based battery application[J]. Journal of Power Sources, 2012, 219: 1-8.
[本文引用: 1]
[35]
HU Y Y, WEN Z Y, WU X W, et al. Nickel nanowire network coating to alleviate interfacial polarization for Na-β battery applications[J]. Journal of Power Sources, 2013, 240: 786-795.
[本文引用: 1]
[36]
CHANG H J, LU X C, BONNETT J F, et al. Decorating β''-alumina solid-state electrolytes with micron Pb spherical particles for improving Na wettability at lower temperatures[J]. Journal of Materials Chemistry A, 2018, 6(40): 19703-19711.
[本文引用: 1]
[37]
GUO X L, ZHANG L Y, DING Y, et al. Room-temperature liquid metal and alloy systems for energy storage applications[J]. Energy & Environmental Science, 2019, 12(9): 2605-2619.
[本文引用: 1]
[38]
LU X C, LI G S, KIM J Y, et al. Liquid-metal electrode to enable ultra-low temperature sodium-beta alumina batteries for renewable energy storage[J]. Nature Communications, 2014, 5: 4578.
[本文引用: 1]
[39]
AHLBRECHT K, BUCHARSKY C, HOLZAPFEL M, et al. Investigation of the wetting behavior of Na and Na alloys on uncoated and coated Na-β"-alumina at temperatures below 150 ℃[J]. Ionics, 2017, 23(5): 1319-1327.
[本文引用: 1]
[40]
LI Y S, TANG Y F, LI X M, et al. In situ TEM studies of sodium polysulfides electrochemistry in high temperature Na-S nanobatteries[J]. Small, 2021, 17(23): e2100846.
[本文引用: 1]
[41]
杜晨阳. 钠硫电池集流体表面Cr3 C2 涂层的制备与高温性能研究[D]. 长沙: 长沙理工大学, 2020.DU C Y. Preparation and high temperature performance of Cr3 C2 coating on the surface of sodium sulfur battery current collector[D]. Changsha: Changsha University of Science & Technology, 2020.
[本文引用: 1]
[42]
WERTH J, KLEIN I, WYLIE R. The sodium chloride battery[C]// Symposium on the energy storage. Electrochemical Society, 1976: 198-205.
[本文引用: 1]
[43]
BIRK J R, WERTH J. Sodium chloride battery development program for load leveling [R]. ESB Technology Center, 1975.
[本文引用: 1]
[44]
COETZER J. A new high energy density battery system[J]. Journal of Power Sources, 1986, 18(4): 377-380.
[本文引用: 2]
[45]
ZHAN X W, LI M M, WELLER J M, et al. Recent progress in cathode materials for sodium-metal halide batteries[J]. Materials, 2021, 14(12): 3260.
[本文引用: 1]
[46]
郭朝有, 徐海, 吴雄学. 钠-氯化镍动力电池安全性能研究[J]. 电源技术, 2014, 38(7): 1259-1261.
[本文引用: 2]
GUO C Y, XU H, WU X X. Research on safety performance of sodium-nickel chloride power battery[J]. Chinese Journal of Power Sources, 2014, 38(7): 1259-1261.
[本文引用: 2]
[47]
曹佳弟.电动汽车用ZEBRA(钠/氯化镍)电池发展现状[J].电池工业,1999, 4(6):221-225.
[本文引用: 1]
CAO J D. Development of ZEBRA (Na/NiCl2 ) battery for EV applications[J]. Battery Industry, 1999, 4(6):221-225.
[本文引用: 1]
[48]
GAO X P, HU Y Y, LI Y P, et al. High-rate and long-life intermediate-temperature Na-NiCl2 battery with dual-functional Ni-carbon composite nanofiber network[J]. ACS Applied Materials & Interfaces, 2020, 12(22): 24767-24776.
[本文引用: 1]
[49]
LI Y P, WU X W, WANG J Y, et al. Ni-less cathode with 3D free-standing conductive network for planar Na-NiCl2 batteries[J]. Chemical Engineering Journal, 2020, 387: 124059.
[本文引用: 1]
[50]
胡英瑛, 王静宜, 吴相伟, 等. 管式ZEBRA电池的长循环性能与电压弛豫曲线的分析研究[J]. 储能科学与技术, 2020, doi: 10.19799/j.cnki.2095-4239.2022.0256.
[本文引用: 1]
HU Y Y, WANG J Y, WU X W, et al. Analysis of long cycle performance and voltage relaxation curves of tubular ZEBRA batteries[J]. Energy Storage Science and Technology, 2022, doi: 10.19799/j.cnki.2095-4239.2022.0256.
[本文引用: 1]
[51]
LI G S, LU X C, KIM J Y, et al. An advanced Na-FeCl2 ZEBRA battery for stationary energy storage application[J]. Advanced Energy Materials, 2015, 5(12): 1500357.
[本文引用: 1]
[52]
AHN C W, KIM M, HAHN B D, et al. Microstructure design of metal composite for active material in sodium nickel-iron chloride battery[J]. Journal of Power Sources, 2016, 329: 50-56.
[本文引用: 1]
[53]
ZHAN X W, BOWDEN M E, LU X C, et al. A low-cost durable Na-FeCl2 battery with ultrahigh rate capability[J]. Advanced Energy Materials, 2020, 10(10): 1903472.
[本文引用: 1]
[54]
LU X C, LI G S, KIM J Y, et al. A novel low-cost sodium-zinc chloride battery[J]. Energy & Environmental Science, 2013, 6(6): 1837.
[本文引用: 1]
[55]
LEE Y, KIM H J, BYUN D J, et al. Electrochemically activated Na-ZnCl2 battery using a carbon matrix in the cathode compartment[J]. Journal of Power Sources, 2019, 440: 227110.
[本文引用: 1]
[56]
LI G S, LU X C, COYLE C A, et al. Novel ternary molten salt electrolytes for intermediate-temperature sodium/nickel chloride batteries[J]. Journal of Power Sources, 2012, 220: 193-198.
[本文引用: 1]
[57]
KIM J, JO S H, BHAVARAJU S, et al. Low temperature performance of sodium-nickel chloride batteries with NASICON solid electrolyte[J]. Journal of Electroanalytical Chemistry, 2015, 759: 201-206.
[本文引用: 1]
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
2
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
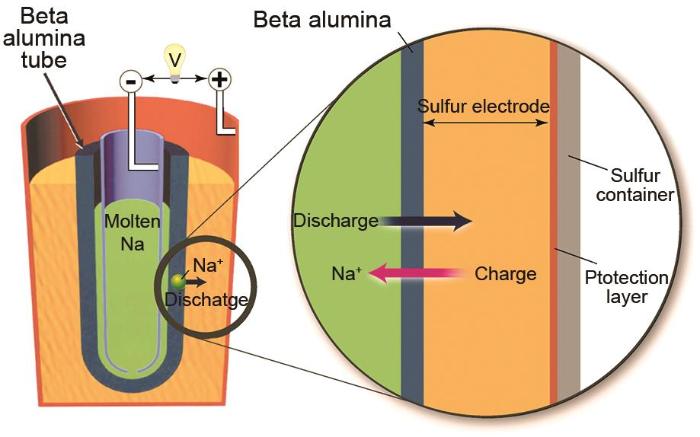
... Na-S电池的发展历史可以追溯到20世纪60年代,早期被用于电动汽车电源[7 ] .NGK公司于1983年开始布局开发用于电网固定式储能的Na-S电池储能系统.2002年,NGK公司实现钠硫电池的批量化生产,并由东京电力公司实现了高温钠硫电池的商业化,至今已在世界各地运营200多个电力储能项目,将钠硫电池储能系统成功实现了4 GWh以上[25 ] .如图4 所示[2 ] ,传统型钠硫电池使用β"-Al2 O3 固态电解质陶瓷管作为电解质兼具正负极隔离以及离子传导的作用,钠金属作为负极置于陶瓷管内,液态硫正极置于管外.钠硫电池组成可表达为(-)Na|β"-Al2 O3 |S/Na2 S x x =3~5,电池基本的化学反应为:2Na+x S↔Na2 S x + 透过β"-Al2 O3 固态电解质与硫在正极形成多硫化钠,充电时Na+ 则回到负极被还原而形成金属钠.高比容量的硫正极(1672 mAh/g)和金属钠负极(1166 mAh/g)赋予了Na-S电池优异的能量密度,目前实际能量密度可达240 Wh/kg,成为最可靠的固定式电网储能电池之一[26 ] . ...
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
1
... 随着人类社会的进步和经济的不断发展,能源需求与日俱增[1 ] .目前,风能和太阳能等新能源发电技术发展迅速,产业规模逐年提高,但其电力输出的不稳定性和不连续性导致并网难度大,不利于电网安全、稳定地运行[2 ] .所以,可用于电网削峰填谷、改善电力质量的储能装置成为全球研究热点,其中化学电源是大规模储能技术的重要发展方向之一[3 ] .在过去的几十年里,锂离子电池(LIBs)由于高能量密度和长循环寿命,占据了消费电子市场的主导地位[4 ] .但是,全球锂资源分布不均,锂基电池市场需求的增加可能会带动成本上升,易造成锂资源供给短缺,限制了其在大规模储能中的应用前景.与此相反,钠在地壳中的丰度为2.6%,仅仅排在氧、硅、铝、铁、钙之后,且全球资源分布广泛,相应原料价格低廉、供给稳定,赋予了钠电池在规模化储能方面的天然优势[5 ] .目前,以钠-硫(Na-S)电池和钠-金属氯化物电池为代表的基于氧化物固态电解质钠电池(OSSBs)(图1 ),具备静态规模储能所特别要求的高功率密度和长服役寿命[6 ] ,在未来规模储能应用中价值巨大.然而,OSSBs在安全性和成本方面仍存在不足,特别是其高的运行温度(>300 ℃),阻碍了其大规模广泛应用.本文结合近年来国内外相关研究工作,介绍OSSBs的基本原理,并对其发展、应用现状和存在的问题进行了综述,并在此基础上提出了对储能钠电池的未来展望. ...
2
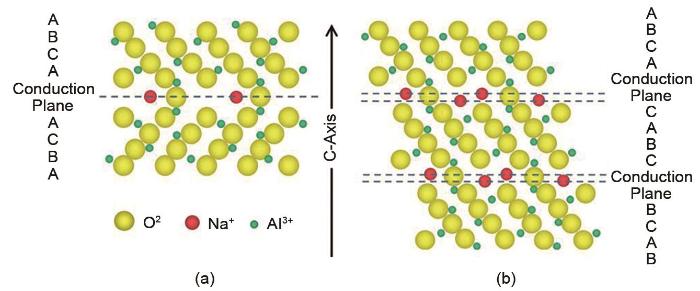
... 早在20世纪60年代美国福特汽车公司首次在陶瓷基氧化铝中发现了钠离子快速传输现象[7 ] .如图2 所示[8 ] ,根据Na与Al的元素比例的大小可将氧化铝基陶瓷的电解质分为β-Al2 O3 与β"-Al2 O3 两种.β"-Al2 O3 材料则由3个尖晶石结构堆砌组成菱面体结构,尖晶石层与Na-O层交替堆积.β"-Al2 O3 结构中含有较多的Na+ 可在电化学反应下进行移动,这种结构使其在300 ℃以上的高温具有较高离子电导率.由于其高离子电导率以及优异的热稳定性,β"-Al2 O3 成为中高温Na-S电池以及钠-金属氯化物电池用固态电解质的主流材料. ...
... Na-S电池的发展历史可以追溯到20世纪60年代,早期被用于电动汽车电源[7 ] .NGK公司于1983年开始布局开发用于电网固定式储能的Na-S电池储能系统.2002年,NGK公司实现钠硫电池的批量化生产,并由东京电力公司实现了高温钠硫电池的商业化,至今已在世界各地运营200多个电力储能项目,将钠硫电池储能系统成功实现了4 GWh以上[25 ] .如图4 所示[2 ] ,传统型钠硫电池使用β"-Al2 O3 固态电解质陶瓷管作为电解质兼具正负极隔离以及离子传导的作用,钠金属作为负极置于陶瓷管内,液态硫正极置于管外.钠硫电池组成可表达为(-)Na|β"-Al2 O3 |S/Na2 S x x =3~5,电池基本的化学反应为:2Na+x S↔Na2 S x + 透过β"-Al2 O3 固态电解质与硫在正极形成多硫化钠,充电时Na+ 则回到负极被还原而形成金属钠.高比容量的硫正极(1672 mAh/g)和金属钠负极(1166 mAh/g)赋予了Na-S电池优异的能量密度,目前实际能量密度可达240 Wh/kg,成为最可靠的固定式电网储能电池之一[26 ] . ...
2
... 早在20世纪60年代美国福特汽车公司首次在陶瓷基氧化铝中发现了钠离子快速传输现象[7 ] .如图2 所示[8 ] ,根据Na与Al的元素比例的大小可将氧化铝基陶瓷的电解质分为β-Al2 O3 与β"-Al2 O3 两种.β"-Al2 O3 材料则由3个尖晶石结构堆砌组成菱面体结构,尖晶石层与Na-O层交替堆积.β"-Al2 O3 结构中含有较多的Na+ 可在电化学反应下进行移动,这种结构使其在300 ℃以上的高温具有较高离子电导率.由于其高离子电导率以及优异的热稳定性,β"-Al2 O3 成为中高温Na-S电池以及钠-金属氯化物电池用固态电解质的主流材料. ...
... 文献
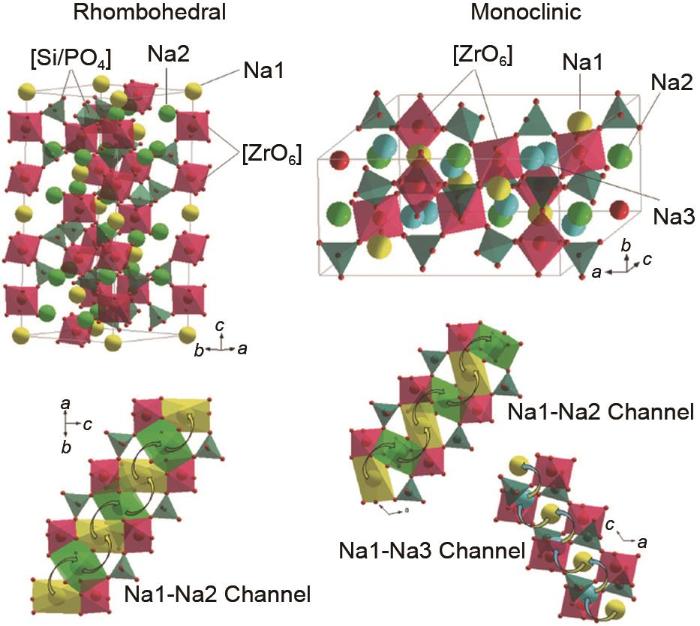
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
1
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
2
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 2004年,Oshima等[9 ] 将β"-Al2 O3 成功应用于高温Na-S电池中.然而,由于β"-Al2 O3 的热力学稳定性较差,很难制备出纯的β"-Al2 O3 ,在β"-Al2 O3 的合成过程中不可避免地会形成一小部分离子电导率较低的β-Al2 O3 .因此,在制备的固体电解质中最大限度地提高β"-Al2 O3 相的比例非常重要.在β"-Al2 O3 的合成过程中添加烧结剂是实现高β"-Al2 O3 相比例的有效策略.例如,Chen等人[10 ] 通过固态反应掺杂MgO合成了高性能的β″-Al2 O3 电解质,结果表明MgO掺杂可以通过降低烧结温度,并显著改善β″-Al2 O3 陶瓷的致密化.当MgO掺杂量为0.4%(质量分数),烧结温度为1550 °C时,制备的β″-Al2 O3 电解质具有最佳的弯曲强度和较高的离子电导率.Yi等[11 ] 在烧结β"-Al2 O3 过程中添加适量的TiO2 和ZrO2 增强了β"-Al2 O3 烧结动力学,在降低烧结温度的同时提高了材料的离子电导率.此外,对β"-Al2 O3 进行掺杂改性也是一种有效提高β"-Al2 O3 相比例的办法.Lee等[12 ] 通过掺杂适量的过渡金属Fe和Ti有效提高β"-Al2 O3 比例,Fe和Ti掺杂的β"-Al2 O3 的最高离子电导率为0.16 S/cm(350 ℃).此外,在β″-Al2 O3 体系中还可以加入了其他的化合物作为稳定剂来抑制β″-Al2 O3 的相变,如NiO、Nb2 O5 、ZrO2 、TiO2 等(表1 )[13 -14 ] . ...
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
1
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
1
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
2
... 文献
β/β″-Al2 O3 β″-Al2 O3 0.2~0.4 (300 ℃) [8 ] β″-Al2 O3 + 0.4% MgO 0.264 (400 ℃) [10 ] β″-Al2 O3 + 1% TiO2 + 10% ZrO2 (质量分数) 0.2 (350 ℃) [11 ] β″-Al2 O3 + 1.5% Ti + 10% Fe(摩尔分数) 0.16 (350 ℃) [12 ] β″-Al2 O3 + 1% Nb2 O5 (质量分数) 0.153 (300 ℃) [13 ] β″-Al2 O3 + 0.25% NiO(质量分数) 0.066 (350 ℃) [14 ] NA-SICON Na3 Zr2 Si2 PO12 6.7×10-4 (RT) [16 ] Na3.4 Sc0.4 Zr1.6 Si2 PO12 4×10-3 (RT) [17 ] Na3.1 Zr1.95 Mg0.05 Si2 PO12 3.5×10-3 (RT) [18 ] Na3.3 Zr1.7 La0.3 Si2 PO12 3.4×10-3 (RT) [19 ] Na3 Zr1.9 Yb0.1 Si2 PO12 2.3×10-3 (RT) [20 ] Na3 Zr1.9 Zn0.1 Si2.2 P0.8 O12 5.27×10-3 (RT) [21 ] 1.2 NA-SICON 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
... 1976年,Goodenough等[15 ] 首先报道了NA-SICON型离子传输材料Na1+ x 2 P3- x x 12 .NA-SICON以其优越的物理化学稳定性、宽电化学窗口以及良好的离子电导率在钠离子固态电解质领域受到广泛关注.NA-SICON属磷酸盐(氧化物)家族,其中以Na1+ x 2 P3- x x 12 (0≤x ≤3)为代表,当x =2时Na3 Zr2 Si2 PO12 室温离子电导率最佳(6.7×10-4 S/cm).如图3 所示[16 ] ,NA-SICON由[SiO4 ]、[PO4 ]四面体和[ZrO6 ]八面体组成,Na1和Na2的两个不同的Na位点在菱面体相中构建了一个三维Na+ 扩散网络,使得大量可移动的Na+ 和可用的相邻空位同时存在,这对Na+ 扩散非常有利.在NA-SICON型化合物中,不同的组成可以导致很大的离子电导率差距.由于在NA-SICON中存在大量的可取代位置,对三维框架中的离子进行部分取代或替换,适当拓宽离子传输路径,是进一步提高材料体相离子电导率的重要方法.近年来,研究者发现NA-SICON型电解质在锆位掺杂稀土元素不仅能降低烧结温度、提高离子电导率,还能通过抑制杂质相形成来提高相纯度.当Zr4+ 被低价阳离子部分取代后会产生正电荷的缺陷,需要额外的Na+ 进行电荷补偿,从而提高Na+ 浓度并提高离子电导率.Ma等[17 ] 选择用Sc3+ (74.5 pm) 进行取代,因为它具有与Zr4+ (72.0pm) 相近的离子半径,因此在掺杂后只会产生正电荷缺陷,不会造成晶体结构扭曲变形.最终具有最佳掺杂量的Na3.4 Sc0.4 Zr1.6 Si2 PO12 在室温时离子电导率可以达到4.0×10-3 S/cm.然而,由于Sc价格昂贵,资源有限,极大地限制了它的应用.Song等[18 ] 发现碱土金属离子可以占据[ZrO6 ]八面体中Zr4+ 的位置,他们通过机械化学法得到了一系列碱土金属元素掺杂的Na3.1 Zr1.95 M0.05 Si2 PO12 (M2+ 掺杂时,材料结构具有最大的离子传输通道,得到的室温离子电导率为3.5×10-3 S/cm.除此之外,还有如Zn2+ 、La3+ 和Yb3+ 等许多可以替代的元素[19 -21 ] ,掺杂后均在一定程度上提升了原始材料的离子电导率.表1 中给出了不同NA-SICON型固态电解质的离子电导率. ...
1
... 然而,硬度大导致的界面接触差以及相对较低的室温离子电导率限制了NA-SICON型固态电解质的进一步应用.目前研究者们通过复合聚合物电解质、对电解质涂层包覆、进行离子(Mg2+ 、Sc3+ 、Ge4+ 、Hf4+ 、Nb5+ 等)掺杂等措施对NA-SICON型固态电解质进行改性,力图构建性能更加优异的固态电解质[22 ] .例如,Shen等[23 ] 设计了一种含有微量离子液体的复合电解质,该电解质由20%聚环氧乙烷以及80% Na3.4 Zr1.9 Zn0.1 Si2.2 P0.8 O12 颗粒组成(质量分数),生成的复合电解质在25 ℃时具有1.48×10-4 S/cm的高离子电导率和对金属钠的良好界面稳定性.Cai等[24 ] 采用金属Pb对NA-SICON结构的Na3 Hf2 Si2 PO12 (NHSP)固态电解质进行表面调控.由于Na和Pb之间形成的界面具有良好的润湿性和快速的电荷传导性,Pb修饰的NHSP与金属钠的润湿角仅为35°. ...
1
... 然而,硬度大导致的界面接触差以及相对较低的室温离子电导率限制了NA-SICON型固态电解质的进一步应用.目前研究者们通过复合聚合物电解质、对电解质涂层包覆、进行离子(Mg2+ 、Sc3+ 、Ge4+ 、Hf4+ 、Nb5+ 等)掺杂等措施对NA-SICON型固态电解质进行改性,力图构建性能更加优异的固态电解质[22 ] .例如,Shen等[23 ] 设计了一种含有微量离子液体的复合电解质,该电解质由20%聚环氧乙烷以及80% Na3.4 Zr1.9 Zn0.1 Si2.2 P0.8 O12 颗粒组成(质量分数),生成的复合电解质在25 ℃时具有1.48×10-4 S/cm的高离子电导率和对金属钠的良好界面稳定性.Cai等[24 ] 采用金属Pb对NA-SICON结构的Na3 Hf2 Si2 PO12 (NHSP)固态电解质进行表面调控.由于Na和Pb之间形成的界面具有良好的润湿性和快速的电荷传导性,Pb修饰的NHSP与金属钠的润湿角仅为35°. ...
1
... 然而,硬度大导致的界面接触差以及相对较低的室温离子电导率限制了NA-SICON型固态电解质的进一步应用.目前研究者们通过复合聚合物电解质、对电解质涂层包覆、进行离子(Mg2+ 、Sc3+ 、Ge4+ 、Hf4+ 、Nb5+ 等)掺杂等措施对NA-SICON型固态电解质进行改性,力图构建性能更加优异的固态电解质[22 ] .例如,Shen等[23 ] 设计了一种含有微量离子液体的复合电解质,该电解质由20%聚环氧乙烷以及80% Na3.4 Zr1.9 Zn0.1 Si2.2 P0.8 O12 颗粒组成(质量分数),生成的复合电解质在25 ℃时具有1.48×10-4 S/cm的高离子电导率和对金属钠的良好界面稳定性.Cai等[24 ] 采用金属Pb对NA-SICON结构的Na3 Hf2 Si2 PO12 (NHSP)固态电解质进行表面调控.由于Na和Pb之间形成的界面具有良好的润湿性和快速的电荷传导性,Pb修饰的NHSP与金属钠的润湿角仅为35°. ...
1
... Na-S电池的发展历史可以追溯到20世纪60年代,早期被用于电动汽车电源[7 ] .NGK公司于1983年开始布局开发用于电网固定式储能的Na-S电池储能系统.2002年,NGK公司实现钠硫电池的批量化生产,并由东京电力公司实现了高温钠硫电池的商业化,至今已在世界各地运营200多个电力储能项目,将钠硫电池储能系统成功实现了4 GWh以上[25 ] .如图4 所示[2 ] ,传统型钠硫电池使用β"-Al2 O3 固态电解质陶瓷管作为电解质兼具正负极隔离以及离子传导的作用,钠金属作为负极置于陶瓷管内,液态硫正极置于管外.钠硫电池组成可表达为(-)Na|β"-Al2 O3 |S/Na2 S x x =3~5,电池基本的化学反应为:2Na+x S↔Na2 S x + 透过β"-Al2 O3 固态电解质与硫在正极形成多硫化钠,充电时Na+ 则回到负极被还原而形成金属钠.高比容量的硫正极(1672 mAh/g)和金属钠负极(1166 mAh/g)赋予了Na-S电池优异的能量密度,目前实际能量密度可达240 Wh/kg,成为最可靠的固定式电网储能电池之一[26 ] . ...
1
... Na-S电池的发展历史可以追溯到20世纪60年代,早期被用于电动汽车电源[7 ] .NGK公司于1983年开始布局开发用于电网固定式储能的Na-S电池储能系统.2002年,NGK公司实现钠硫电池的批量化生产,并由东京电力公司实现了高温钠硫电池的商业化,至今已在世界各地运营200多个电力储能项目,将钠硫电池储能系统成功实现了4 GWh以上[25 ] .如图4 所示[2 ] ,传统型钠硫电池使用β"-Al2 O3 固态电解质陶瓷管作为电解质兼具正负极隔离以及离子传导的作用,钠金属作为负极置于陶瓷管内,液态硫正极置于管外.钠硫电池组成可表达为(-)Na|β"-Al2 O3 |S/Na2 S x x =3~5,电池基本的化学反应为:2Na+x S↔Na2 S x + 透过β"-Al2 O3 固态电解质与硫在正极形成多硫化钠,充电时Na+ 则回到负极被还原而形成金属钠.高比容量的硫正极(1672 mAh/g)和金属钠负极(1166 mAh/g)赋予了Na-S电池优异的能量密度,目前实际能量密度可达240 Wh/kg,成为最可靠的固定式电网储能电池之一[26 ] . ...
1
... Na-S电池的发展历史可以追溯到20世纪60年代,早期被用于电动汽车电源[7 ] .NGK公司于1983年开始布局开发用于电网固定式储能的Na-S电池储能系统.2002年,NGK公司实现钠硫电池的批量化生产,并由东京电力公司实现了高温钠硫电池的商业化,至今已在世界各地运营200多个电力储能项目,将钠硫电池储能系统成功实现了4 GWh以上[25 ] .如图4 所示[2 ] ,传统型钠硫电池使用β"-Al2 O3 固态电解质陶瓷管作为电解质兼具正负极隔离以及离子传导的作用,钠金属作为负极置于陶瓷管内,液态硫正极置于管外.钠硫电池组成可表达为(-)Na|β"-Al2 O3 |S/Na2 S x x =3~5,电池基本的化学反应为:2Na+x S↔Na2 S x + 透过β"-Al2 O3 固态电解质与硫在正极形成多硫化钠,充电时Na+ 则回到负极被还原而形成金属钠.高比容量的硫正极(1672 mAh/g)和金属钠负极(1166 mAh/g)赋予了Na-S电池优异的能量密度,目前实际能量密度可达240 Wh/kg,成为最可靠的固定式电网储能电池之一[26 ] . ...
1
... 然而,为了保证金属钠和单质硫的液态特征以及β"-Al2 O3 固态电解质的高效离子传导,Na-S电池的运行通常需保持在300~350 ℃,高的运行温度始终存在令人担忧的安全隐患,阻碍了其更广泛的应用.最为严重的Na-S电池安全事件发生在2011年9月21日,由东京电力公司在三菱材料株式会社(Mitsubishi Materials Corporation)筑波厂建造运行的Na-S电池系统(NGK生产)出现火情[27 ] ,历时2周之久.因此,Na-S电池的安全性成为其进一步的发展面临的首要挑战之一,也是近几年的研究重点.在高温状态下,液态钠与熔融硫发生反应的理论反应焓为-420 kJ/mol[28 ] .一旦陶瓷氧化物电解质破损,液态钠和硫就会直接接触而形成短路,会导致温度迅速上升至2000 ℃,造成严重的热失控,因此,防止β"-Al2 O3 陶瓷管破裂是提高Na-S电池安全性的策略之一.目前主要通过提高氧化物固态电解质的机械强度及降低固体电解质局部电流密度等方法来防止陶瓷管的破裂. ...
1
... 然而,为了保证金属钠和单质硫的液态特征以及β"-Al2 O3 固态电解质的高效离子传导,Na-S电池的运行通常需保持在300~350 ℃,高的运行温度始终存在令人担忧的安全隐患,阻碍了其更广泛的应用.最为严重的Na-S电池安全事件发生在2011年9月21日,由东京电力公司在三菱材料株式会社(Mitsubishi Materials Corporation)筑波厂建造运行的Na-S电池系统(NGK生产)出现火情[27 ] ,历时2周之久.因此,Na-S电池的安全性成为其进一步的发展面临的首要挑战之一,也是近几年的研究重点.在高温状态下,液态钠与熔融硫发生反应的理论反应焓为-420 kJ/mol[28 ] .一旦陶瓷氧化物电解质破损,液态钠和硫就会直接接触而形成短路,会导致温度迅速上升至2000 ℃,造成严重的热失控,因此,防止β"-Al2 O3 陶瓷管破裂是提高Na-S电池安全性的策略之一.目前主要通过提高氧化物固态电解质的机械强度及降低固体电解质局部电流密度等方法来防止陶瓷管的破裂. ...
1
... 然而,为了保证金属钠和单质硫的液态特征以及β"-Al2 O3 固态电解质的高效离子传导,Na-S电池的运行通常需保持在300~350 ℃,高的运行温度始终存在令人担忧的安全隐患,阻碍了其更广泛的应用.最为严重的Na-S电池安全事件发生在2011年9月21日,由东京电力公司在三菱材料株式会社(Mitsubishi Materials Corporation)筑波厂建造运行的Na-S电池系统(NGK生产)出现火情[27 ] ,历时2周之久.因此,Na-S电池的安全性成为其进一步的发展面临的首要挑战之一,也是近几年的研究重点.在高温状态下,液态钠与熔融硫发生反应的理论反应焓为-420 kJ/mol[28 ] .一旦陶瓷氧化物电解质破损,液态钠和硫就会直接接触而形成短路,会导致温度迅速上升至2000 ℃,造成严重的热失控,因此,防止β"-Al2 O3 陶瓷管破裂是提高Na-S电池安全性的策略之一.目前主要通过提高氧化物固态电解质的机械强度及降低固体电解质局部电流密度等方法来防止陶瓷管的破裂. ...
1
... Viswanathan等[29 ] 在β"-Al2 O3 的高温烧结过程中掺入质量分数为15%的ZrO2 ,显著提高了β"-Al2 O3 陶瓷管的韧性以及抗断裂强度.经测试,ZrO2 的掺入将β"-Al2 O3 陶瓷管断裂韧性范围从2.5~3 MN∙m-3/2 提高到5.0~8.0 MN∙m-3/2 .随后,Liu等[30 ] 探究了添加YSZ(氧化钇稳定氧化锆)对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料的微观结构和力学性能的影响.研究结果表明,YSZ的加入促进了复合材料的致密化和四方ZrO2 相的形成,复合材料表现出更高的断裂韧性.2019年,该团队进一步探究了不同氧化钇(Y2 O3 )含量的YSZ对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料增韧效果的影响,发现YSZ的掺入导致Al2 O3 晶粒细化,而只添加Y2 O3 的复合材料显示出更大的Al2 O3 基体晶粒尺寸.加入体积分数7.5%的YSZ颗粒后,最大断裂韧性值可达5.7 MPa∙m1/2 ,抗弯强度达481.8 MPa[31 ] .近期,Lee等[32 ] 在β"-Al2 O3 烧结过程中加入MnO2 ,结果表明质量分数0.6%~2%的MnO2 可以较好地提升烧结样品的相对密度,从而起到提高β"-Al2 O3 陶瓷管韧性的目的. ...
1
... Viswanathan等[29 ] 在β"-Al2 O3 的高温烧结过程中掺入质量分数为15%的ZrO2 ,显著提高了β"-Al2 O3 陶瓷管的韧性以及抗断裂强度.经测试,ZrO2 的掺入将β"-Al2 O3 陶瓷管断裂韧性范围从2.5~3 MN∙m-3/2 提高到5.0~8.0 MN∙m-3/2 .随后,Liu等[30 ] 探究了添加YSZ(氧化钇稳定氧化锆)对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料的微观结构和力学性能的影响.研究结果表明,YSZ的加入促进了复合材料的致密化和四方ZrO2 相的形成,复合材料表现出更高的断裂韧性.2019年,该团队进一步探究了不同氧化钇(Y2 O3 )含量的YSZ对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料增韧效果的影响,发现YSZ的掺入导致Al2 O3 晶粒细化,而只添加Y2 O3 的复合材料显示出更大的Al2 O3 基体晶粒尺寸.加入体积分数7.5%的YSZ颗粒后,最大断裂韧性值可达5.7 MPa∙m1/2 ,抗弯强度达481.8 MPa[31 ] .近期,Lee等[32 ] 在β"-Al2 O3 烧结过程中加入MnO2 ,结果表明质量分数0.6%~2%的MnO2 可以较好地提升烧结样品的相对密度,从而起到提高β"-Al2 O3 陶瓷管韧性的目的. ...
1
... Viswanathan等[29 ] 在β"-Al2 O3 的高温烧结过程中掺入质量分数为15%的ZrO2 ,显著提高了β"-Al2 O3 陶瓷管的韧性以及抗断裂强度.经测试,ZrO2 的掺入将β"-Al2 O3 陶瓷管断裂韧性范围从2.5~3 MN∙m-3/2 提高到5.0~8.0 MN∙m-3/2 .随后,Liu等[30 ] 探究了添加YSZ(氧化钇稳定氧化锆)对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料的微观结构和力学性能的影响.研究结果表明,YSZ的加入促进了复合材料的致密化和四方ZrO2 相的形成,复合材料表现出更高的断裂韧性.2019年,该团队进一步探究了不同氧化钇(Y2 O3 )含量的YSZ对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料增韧效果的影响,发现YSZ的掺入导致Al2 O3 晶粒细化,而只添加Y2 O3 的复合材料显示出更大的Al2 O3 基体晶粒尺寸.加入体积分数7.5%的YSZ颗粒后,最大断裂韧性值可达5.7 MPa∙m1/2 ,抗弯强度达481.8 MPa[31 ] .近期,Lee等[32 ] 在β"-Al2 O3 烧结过程中加入MnO2 ,结果表明质量分数0.6%~2%的MnO2 可以较好地提升烧结样品的相对密度,从而起到提高β"-Al2 O3 陶瓷管韧性的目的. ...
1
... Viswanathan等[29 ] 在β"-Al2 O3 的高温烧结过程中掺入质量分数为15%的ZrO2 ,显著提高了β"-Al2 O3 陶瓷管的韧性以及抗断裂强度.经测试,ZrO2 的掺入将β"-Al2 O3 陶瓷管断裂韧性范围从2.5~3 MN∙m-3/2 提高到5.0~8.0 MN∙m-3/2 .随后,Liu等[30 ] 探究了添加YSZ(氧化钇稳定氧化锆)对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料的微观结构和力学性能的影响.研究结果表明,YSZ的加入促进了复合材料的致密化和四方ZrO2 相的形成,复合材料表现出更高的断裂韧性.2019年,该团队进一步探究了不同氧化钇(Y2 O3 )含量的YSZ对Al2 O3 /β"-Al2 O3 /ZrO2 复合材料增韧效果的影响,发现YSZ的掺入导致Al2 O3 晶粒细化,而只添加Y2 O3 的复合材料显示出更大的Al2 O3 基体晶粒尺寸.加入体积分数7.5%的YSZ颗粒后,最大断裂韧性值可达5.7 MPa∙m1/2 ,抗弯强度达481.8 MPa[31 ] .近期,Lee等[32 ] 在β"-Al2 O3 烧结过程中加入MnO2 ,结果表明质量分数0.6%~2%的MnO2 可以较好地提升烧结样品的相对密度,从而起到提高β"-Al2 O3 陶瓷管韧性的目的. ...
1
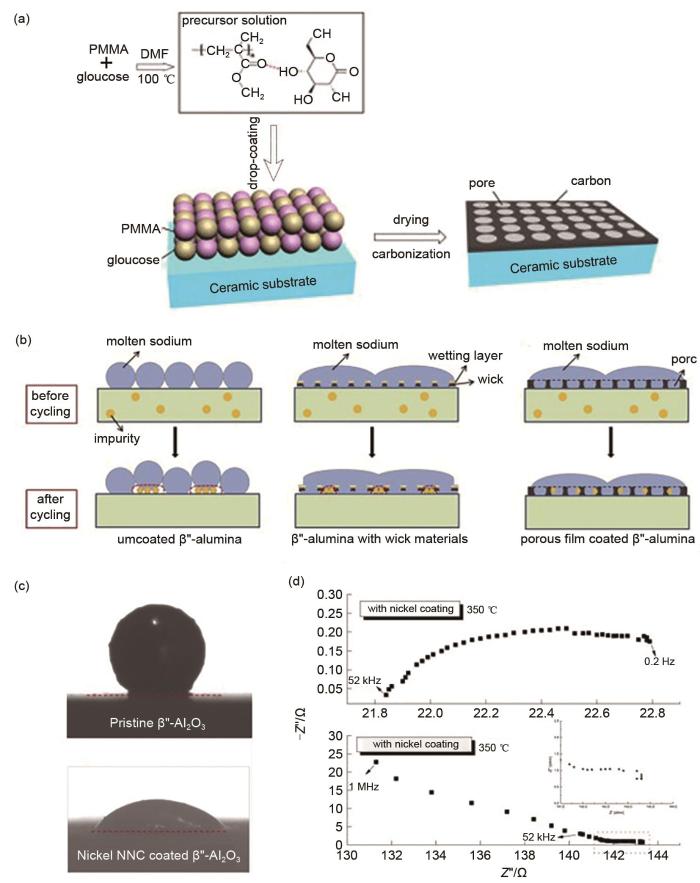
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 另一个防止陶瓷管破裂的有效方法是降低固体电解质局部电流密度.虽然β"-Al2 O3 与正极侧的硫/多硫化物不会发生化学副反应,但循环后的β"-Al2 O3 却仍然易发生退化的现象.研究表明这是因为β"-Al2 O3 对钠金属的浸润性差而导致β"-Al2 O3 陶瓷管局部电流密度增大所造成的[33 ] .在β"-Al2 O3 陶瓷管表面涂覆一层对钠金属浸润性强的涂层[如碳质材料以及镍(Ni)、铅(Pb)涂层等]是降低固体电解质局部电流密度的最常用方法.2012年Hu等[34 ] 以葡萄糖和聚甲基丙烯酸甲酯(PMMA)为前体,制备了多孔碳膜修饰的β"-Al2 O3 电解质,提高了β"-Al2 O3 对钠金属的浸润性[图5 (a)].在300 ℃下,钠液滴与多孔碳涂层的β"-Al2 O3 电解质的接触角为94.5°,远远小于纯β"-Al2 O3 电解质与钠的接触角(151°),进而有效降低了电池的局部电流密度和电化学极化.2013年,该团队又设计了一种镍金属纳米线网络涂层的β"-Al2 O3 电解质[35 ] ,该涂层由直径约为100 nm的镍纳米线组成,且呈现高度多孔的形态[图5 (b)].300 ℃时,镍纳米线涂层β"-Al2 O3 电解质上熔融钠液滴的接触角减小到了40°[图5 (c)],并且该涂层具有低的电子电阻(约为1 Ω/m2 )[图5 (d)],极大地提高了β"-Al2 O3 陶瓷电解质对钠金属的浸润性.最近,Chang等[36 ] 利用水合乙酸铅对β"-Al2 O3 固态电解质进行表面改性,处理后的β"-Al2 O3 电解质表面形成了一层微米级铅颗粒的涂层,改性后的β"-Al2 O3 对钠液滴的接触角在200 ℃时甚至仅有16°,进一步改善了β"-Al2 O3 电解质对钠金属的浸润性,为降低固体电解质局部电流密度提供了有效的解决方案.同时研究发现,不同的碱金属,如钾(K)、铷(Rb)和铯(Cs),与钠形成的合金同样也可以提高与β"-Al2 O3 固态电解质的浸润性[37 ] .例如,Lu等[38 ] 在Na中加入摩尔分数5%的碱金属Cs进行合金化,在100 ℃下,NaCs合金与固态电解质的接触角为88.6°,这与250 ℃下纯Na和固态电解质的接触角相当.此外,其他过渡金属元素(如Sn)也被证明具有提高钠负极对β"-Al2 O3 固体电解质浸润性的作用[39 ] . ...
1
... 与此同时,单质硫或多硫化物对集流体的腐蚀同样会导致Na-S电池容量的快速衰减.Li等[40 ] 通过原位透射电镜配备电系统加热装置研究循环过程中多硫化物的生成和转化过程.在放电过程中,硫正极发生了从S8 到Na2 S x x ≥6),然后生成Na2 S5 、Na2 S4 、Na2 S2 ,最后生成Na2 S.目前,解决的办法主要是在集流体中引入抗腐蚀的金属图层,比如Mo、Cr、Al等.此外,杜晨阳[41 ] 通过磁控溅射在不锈钢集流体表面沉积了Cr3 C2 涂层来解决多硫化物对集流体的腐蚀.扫描电子显微镜(SEM)分析发现,沉积的Cr3 C2 涂层在350 ℃的熔融多硫化钠中腐蚀180 h后,涂层部分表面变成絮状结构,但涂层整体较为完整,没有明显的点蚀坑或剥落的现象.从腐蚀后的X射线衍射仪(XRD)图谱中可见,生成了少量的NaCrS2 和Cr2 S3 等物质,这是由于涂层中存在的单质Cr与腐蚀介质发生了反应. ...
1
... 与此同时,单质硫或多硫化物对集流体的腐蚀同样会导致Na-S电池容量的快速衰减.Li等[40 ] 通过原位透射电镜配备电系统加热装置研究循环过程中多硫化物的生成和转化过程.在放电过程中,硫正极发生了从S8 到Na2 S x x ≥6),然后生成Na2 S5 、Na2 S4 、Na2 S2 ,最后生成Na2 S.目前,解决的办法主要是在集流体中引入抗腐蚀的金属图层,比如Mo、Cr、Al等.此外,杜晨阳[41 ] 通过磁控溅射在不锈钢集流体表面沉积了Cr3 C2 涂层来解决多硫化物对集流体的腐蚀.扫描电子显微镜(SEM)分析发现,沉积的Cr3 C2 涂层在350 ℃的熔融多硫化钠中腐蚀180 h后,涂层部分表面变成絮状结构,但涂层整体较为完整,没有明显的点蚀坑或剥落的现象.从腐蚀后的X射线衍射仪(XRD)图谱中可见,生成了少量的NaCrS2 和Cr2 S3 等物质,这是由于涂层中存在的单质Cr与腐蚀介质发生了反应. ...
1
... 从目前来看,Na-S电池在安全性方面还需进一步提高,尤其是考虑到其运行温度必须维持在300~350 ℃的高温条件.为此,Werth等[42 ] 用溶于四氯铝酸钠(NaAlCl4 )熔盐中的三氯化锑(SbCl3 )取代硫电极,使电池工作温度低至210 ℃.但是,因SbCl3 电极溶于NaAlCl4 熔盐,在充放电过程中,Sb3+ 会自发地向陶瓷电解质一侧移动,继而与其中的Na+ 进行离子交换,造成陶瓷管退化,影响电池性能;另一方面,正极材料的溶解度过高,造成活性Sb3+ 无法在集流体上发生电化学反应,电池的容量损失增大.这直接促使了钠-金属氯化物电池的诞生. ...
1
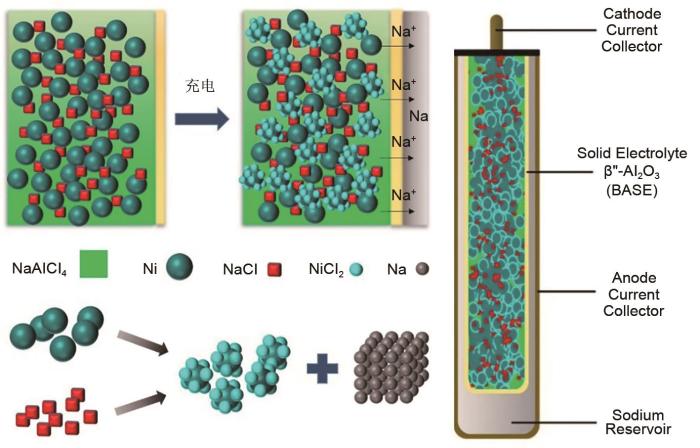
... 随着对Na-S电池研究工作不断深入,南非ZEBRA Power Systems公司的Johan Coetzer教授认识到Na-S电池存在的很多技术问题和性能限制是由于硫电极引起的.因此,如果有其他正极材料可替代,安全、可靠的高温钠电池依然是可行的.在Werth工作基础上[43 ] ,Johan Coetzer等[44 ] 研究了不溶于NaAlCl4 熔盐中的过渡金属元素的氯化物,旨在解决SbCl3 电极溶于NaAlCl4 熔盐中的问题,并提出一种新型钠电池,即钠-金属氯化物电池.其中,以NiCl2 作为活性电极材料的钠-氯化镍电池(Zebra电池)为典型代表.如图6 所示[45 ] ,Zebra电池与Na-S电池结构相似,负极采用液态金属钠,β"-Al2 O3 陶瓷作为固态电解质;区别是由液态的NaAlCl4 熔盐与固态的金属氯化镍组成正极材料.相比于Na-S电池,Zebra电池拥有略低的工作温度,为270~320 ℃,更高的开路电压,为2.58 V (300 ℃).Zebra电池的基本电池反应是:2Na+NiCl2 ↔2NaCl+Ni.在放电态下组装的Zebra电池,正极以NaCl和Ni为初始材料,避免了直接使用钠金属负极,因此电池制备过程安全性高.钠金属负极是由首圈充电过程中来自正极材料NaCl的Na+ 通过β"-Al2 O3 固体电解质迁移到负极所生成.与此同时,正极中的Ni失电子后形成Ni2+ 与Cl- 在Ni颗粒表面形成NiCl2 .正极液态的NaAlCl4 熔盐的存在巧妙避免了电解质和正极活性材料之间的固-固接触,通过有效Na+ 介导保证了正极与固态电解质的离子的高效转移. ...
2
... 随着对Na-S电池研究工作不断深入,南非ZEBRA Power Systems公司的Johan Coetzer教授认识到Na-S电池存在的很多技术问题和性能限制是由于硫电极引起的.因此,如果有其他正极材料可替代,安全、可靠的高温钠电池依然是可行的.在Werth工作基础上[43 ] ,Johan Coetzer等[44 ] 研究了不溶于NaAlCl4 熔盐中的过渡金属元素的氯化物,旨在解决SbCl3 电极溶于NaAlCl4 熔盐中的问题,并提出一种新型钠电池,即钠-金属氯化物电池.其中,以NiCl2 作为活性电极材料的钠-氯化镍电池(Zebra电池)为典型代表.如图6 所示[45 ] ,Zebra电池与Na-S电池结构相似,负极采用液态金属钠,β"-Al2 O3 陶瓷作为固态电解质;区别是由液态的NaAlCl4 熔盐与固态的金属氯化镍组成正极材料.相比于Na-S电池,Zebra电池拥有略低的工作温度,为270~320 ℃,更高的开路电压,为2.58 V (300 ℃).Zebra电池的基本电池反应是:2Na+NiCl2 ↔2NaCl+Ni.在放电态下组装的Zebra电池,正极以NaCl和Ni为初始材料,避免了直接使用钠金属负极,因此电池制备过程安全性高.钠金属负极是由首圈充电过程中来自正极材料NaCl的Na+ 通过β"-Al2 O3 固体电解质迁移到负极所生成.与此同时,正极中的Ni失电子后形成Ni2+ 与Cl- 在Ni颗粒表面形成NiCl2 .正极液态的NaAlCl4 熔盐的存在巧妙避免了电解质和正极活性材料之间的固-固接触,通过有效Na+ 介导保证了正极与固态电解质的离子的高效转移. ...
... 我国铁资源储量丰富,居世界第9位,广泛分布于全国31个省市.因此,将铁基电极材料应用于钠-氯化物电池对降低其成本具有现实意义.FeCl2 作为正极应用在熔融钠金属电池的报道最早出现在1986年(图8 )[44 ] ,其运行温度约为250 ℃,开路电压为2.35 V.2015年,Li等[51 ] 设计了一种新型钠-氯化亚铁(Na-FeCl2 )电池,首次在FeCl2 正极中使用少量的S作为正极添加剂,使Na-FeCl2 电池可以在<200 ℃下运行,并且电池具有快速充电能力.2016年,Ahn等[52 ] 提出了一种镍-铁复合材料的微观结构(图9 ),其中Ni作为添加剂.当Ni颗粒粒径大于Fe颗粒时,Fe颗粒会聚集在Ni颗粒之上,在正极中形成了紧凑且均匀的形貌.这不仅降低了电池成本,还兼顾了优异的循环性能,充放电100次循环后,Na-(Ni/Fe)Cl2 电池容量保持率约为65%,远高于Zebra电池(容量保持率约为40%).最近,Zhan等[53 ] 进一步设计了一种可以在190 ℃下运行的Na-FeCl2 电池(少量Ni作为添加剂).在33.3 mA/cm2 的电流密度下,该正极具有116 mAh/g的比容量.在电流密度10 mA/cm2 条件下,电池放电能量密度超过295 Wh/kg.并且,研究明确指出FeCl2 正极中少量(摩尔分数10%)的Ni作为添加剂,可以有效减轻电池过充(形成不可逆的FeCl3 )而造成铁颗粒粉碎引发的电池的容量衰减.虽然正极仍使用少量Ni,但FeCl2 作为主要正极活性物质有效降低了Zebra电池成本. ...
1
... 随着对Na-S电池研究工作不断深入,南非ZEBRA Power Systems公司的Johan Coetzer教授认识到Na-S电池存在的很多技术问题和性能限制是由于硫电极引起的.因此,如果有其他正极材料可替代,安全、可靠的高温钠电池依然是可行的.在Werth工作基础上[43 ] ,Johan Coetzer等[44 ] 研究了不溶于NaAlCl4 熔盐中的过渡金属元素的氯化物,旨在解决SbCl3 电极溶于NaAlCl4 熔盐中的问题,并提出一种新型钠电池,即钠-金属氯化物电池.其中,以NiCl2 作为活性电极材料的钠-氯化镍电池(Zebra电池)为典型代表.如图6 所示[45 ] ,Zebra电池与Na-S电池结构相似,负极采用液态金属钠,β"-Al2 O3 陶瓷作为固态电解质;区别是由液态的NaAlCl4 熔盐与固态的金属氯化镍组成正极材料.相比于Na-S电池,Zebra电池拥有略低的工作温度,为270~320 ℃,更高的开路电压,为2.58 V (300 ℃).Zebra电池的基本电池反应是:2Na+NiCl2 ↔2NaCl+Ni.在放电态下组装的Zebra电池,正极以NaCl和Ni为初始材料,避免了直接使用钠金属负极,因此电池制备过程安全性高.钠金属负极是由首圈充电过程中来自正极材料NaCl的Na+ 通过β"-Al2 O3 固体电解质迁移到负极所生成.与此同时,正极中的Ni失电子后形成Ni2+ 与Cl- 在Ni颗粒表面形成NiCl2 .正极液态的NaAlCl4 熔盐的存在巧妙避免了电解质和正极活性材料之间的固-固接触,通过有效Na+ 介导保证了正极与固态电解质的离子的高效转移. ...
2
... 重要的是,相比Na-S电池,Zebra电池本质上具有高安全性.即便当电池损坏或者陶瓷电解质管发生破裂时,正负极直接接触,也无明显的安全风险.这是由于熔融钠与NaAlCl4 熔盐电解质之间发生化学反应NaAlCl4 +3Na→4NaCl+Al,从而将熔融钠经化学反应转变为固态NaCl,避免了Na与氧气接触发生剧烈氧化反应的潜在危险[46 ] .同时,该反应的理论比能量仅为650 Wh/kg,是Zebra电池正常放电反应式的理论比能量(788 Wh/kg)的82%,不易导致电池热失控[46 ] .此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
... [46 ].此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
2
... 重要的是,相比Na-S电池,Zebra电池本质上具有高安全性.即便当电池损坏或者陶瓷电解质管发生破裂时,正负极直接接触,也无明显的安全风险.这是由于熔融钠与NaAlCl4 熔盐电解质之间发生化学反应NaAlCl4 +3Na→4NaCl+Al,从而将熔融钠经化学反应转变为固态NaCl,避免了Na与氧气接触发生剧烈氧化反应的潜在危险[46 ] .同时,该反应的理论比能量仅为650 Wh/kg,是Zebra电池正常放电反应式的理论比能量(788 Wh/kg)的82%,不易导致电池热失控[46 ] .此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
... [46 ].此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
1
... 重要的是,相比Na-S电池,Zebra电池本质上具有高安全性.即便当电池损坏或者陶瓷电解质管发生破裂时,正负极直接接触,也无明显的安全风险.这是由于熔融钠与NaAlCl4 熔盐电解质之间发生化学反应NaAlCl4 +3Na→4NaCl+Al,从而将熔融钠经化学反应转变为固态NaCl,避免了Na与氧气接触发生剧烈氧化反应的潜在危险[46 ] .同时,该反应的理论比能量仅为650 Wh/kg,是Zebra电池正常放电反应式的理论比能量(788 Wh/kg)的82%,不易导致电池热失控[46 ] .此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
1
... 重要的是,相比Na-S电池,Zebra电池本质上具有高安全性.即便当电池损坏或者陶瓷电解质管发生破裂时,正负极直接接触,也无明显的安全风险.这是由于熔融钠与NaAlCl4 熔盐电解质之间发生化学反应NaAlCl4 +3Na→4NaCl+Al,从而将熔融钠经化学反应转变为固态NaCl,避免了Na与氧气接触发生剧烈氧化反应的潜在危险[46 ] .同时,该反应的理论比能量仅为650 Wh/kg,是Zebra电池正常放电反应式的理论比能量(788 Wh/kg)的82%,不易导致电池热失控[46 ] .此外,Zebra电池所有组成材料在其工作温度范围都呈低蒸气压状态(表2 列出了Zebra电池正、负极、电解质材料的沸点),保证了电池正常工作过程不会析出任何气体[47 ] .可见,不论从工作原理还是组成材料物性方面,Zebra电池都具有高的安全性能. ...
1
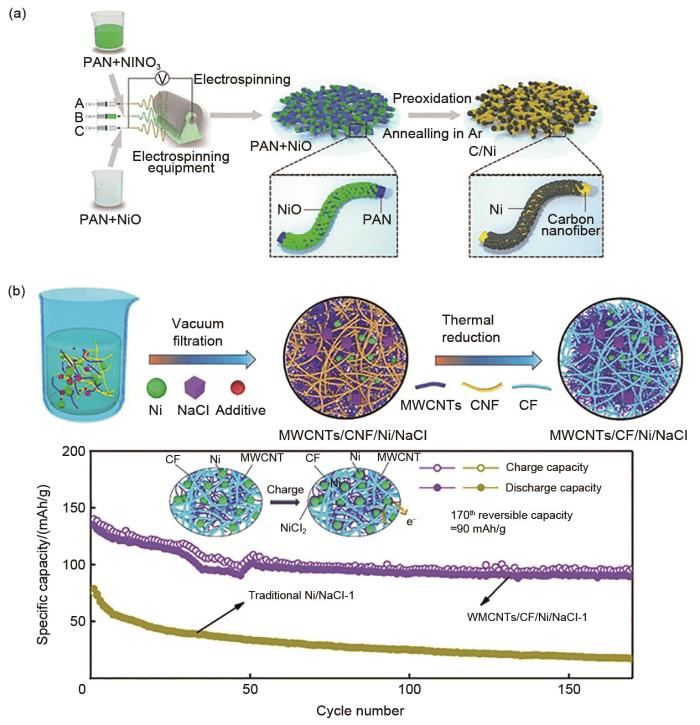
... 正极颗粒(Ni、NiCl2 、NaCl)无规生长和粗化是导致Zebra电池循环稳定性差的主要原因之一.在电池连续的充放电过程中,正极发生连续的多相转化反应,活性成分动态变化,易发生团聚,电化学反应的活性表面积缩小,导致电池极化增加.针对此问题,一些研究人员开发了镍-碳复合正极,通过使用碳孔限制Ni颗粒的生长进而提高电池寿命.Gao等[48 ] 通过静电纺丝和电沉积法合成镍-碳纳米纤维复合网络(NCCNs),构建了一种新型的Zebra电池三维正极[图7 (a)].通过碳纤维限制Ni和NaCl晶粒的体积膨胀,结果表明,充放电50次循环后,它们的尺寸分别小于500 nm和7 µm,大大提高了电池的容量和循环寿命.此外,该复合正极在338 mA/g的高电流下,充放电循环350次后容量没有明显减少.随后,Li等[49 ] 设计了一种3D结构正极,其由碳纤维(CF)和多壁碳纳米管(MWCNT)作为导电基体,Ni以及NaCl颗粒均匀地分布在结构之中[图7 (b)].通过3D碳基体的分层结构抑制Ni和NaCl正极颗粒的长大.经过170圈循环后,电池容量仍保持在90 mAh/g.最近,中国科学院上海硅酸盐研究所温兆银研究员等[50 ] 结合Zebra电池的正极颗粒特征、长循环性能曲线与放电电压弛豫曲线进行了分析,得到Zebra电池将经历前期活化、中期稳定和后期性能老化等3个不同的性能阶段.通过观察电池的电压弛豫曲线的变化,可以较好地判断电池性能所处的阶段,从而获取电池的健康状态.并以此判断为基础,通过改变阴极的组成可减少电池活化时间,达到保持电池长循环稳定性的目的. ...
1
... 正极颗粒(Ni、NiCl2 、NaCl)无规生长和粗化是导致Zebra电池循环稳定性差的主要原因之一.在电池连续的充放电过程中,正极发生连续的多相转化反应,活性成分动态变化,易发生团聚,电化学反应的活性表面积缩小,导致电池极化增加.针对此问题,一些研究人员开发了镍-碳复合正极,通过使用碳孔限制Ni颗粒的生长进而提高电池寿命.Gao等[48 ] 通过静电纺丝和电沉积法合成镍-碳纳米纤维复合网络(NCCNs),构建了一种新型的Zebra电池三维正极[图7 (a)].通过碳纤维限制Ni和NaCl晶粒的体积膨胀,结果表明,充放电50次循环后,它们的尺寸分别小于500 nm和7 µm,大大提高了电池的容量和循环寿命.此外,该复合正极在338 mA/g的高电流下,充放电循环350次后容量没有明显减少.随后,Li等[49 ] 设计了一种3D结构正极,其由碳纤维(CF)和多壁碳纳米管(MWCNT)作为导电基体,Ni以及NaCl颗粒均匀地分布在结构之中[图7 (b)].通过3D碳基体的分层结构抑制Ni和NaCl正极颗粒的长大.经过170圈循环后,电池容量仍保持在90 mAh/g.最近,中国科学院上海硅酸盐研究所温兆银研究员等[50 ] 结合Zebra电池的正极颗粒特征、长循环性能曲线与放电电压弛豫曲线进行了分析,得到Zebra电池将经历前期活化、中期稳定和后期性能老化等3个不同的性能阶段.通过观察电池的电压弛豫曲线的变化,可以较好地判断电池性能所处的阶段,从而获取电池的健康状态.并以此判断为基础,通过改变阴极的组成可减少电池活化时间,达到保持电池长循环稳定性的目的. ...
1
... 正极颗粒(Ni、NiCl2 、NaCl)无规生长和粗化是导致Zebra电池循环稳定性差的主要原因之一.在电池连续的充放电过程中,正极发生连续的多相转化反应,活性成分动态变化,易发生团聚,电化学反应的活性表面积缩小,导致电池极化增加.针对此问题,一些研究人员开发了镍-碳复合正极,通过使用碳孔限制Ni颗粒的生长进而提高电池寿命.Gao等[48 ] 通过静电纺丝和电沉积法合成镍-碳纳米纤维复合网络(NCCNs),构建了一种新型的Zebra电池三维正极[图7 (a)].通过碳纤维限制Ni和NaCl晶粒的体积膨胀,结果表明,充放电50次循环后,它们的尺寸分别小于500 nm和7 µm,大大提高了电池的容量和循环寿命.此外,该复合正极在338 mA/g的高电流下,充放电循环350次后容量没有明显减少.随后,Li等[49 ] 设计了一种3D结构正极,其由碳纤维(CF)和多壁碳纳米管(MWCNT)作为导电基体,Ni以及NaCl颗粒均匀地分布在结构之中[图7 (b)].通过3D碳基体的分层结构抑制Ni和NaCl正极颗粒的长大.经过170圈循环后,电池容量仍保持在90 mAh/g.最近,中国科学院上海硅酸盐研究所温兆银研究员等[50 ] 结合Zebra电池的正极颗粒特征、长循环性能曲线与放电电压弛豫曲线进行了分析,得到Zebra电池将经历前期活化、中期稳定和后期性能老化等3个不同的性能阶段.通过观察电池的电压弛豫曲线的变化,可以较好地判断电池性能所处的阶段,从而获取电池的健康状态.并以此判断为基础,通过改变阴极的组成可减少电池活化时间,达到保持电池长循环稳定性的目的. ...
1
... 正极颗粒(Ni、NiCl2 、NaCl)无规生长和粗化是导致Zebra电池循环稳定性差的主要原因之一.在电池连续的充放电过程中,正极发生连续的多相转化反应,活性成分动态变化,易发生团聚,电化学反应的活性表面积缩小,导致电池极化增加.针对此问题,一些研究人员开发了镍-碳复合正极,通过使用碳孔限制Ni颗粒的生长进而提高电池寿命.Gao等[48 ] 通过静电纺丝和电沉积法合成镍-碳纳米纤维复合网络(NCCNs),构建了一种新型的Zebra电池三维正极[图7 (a)].通过碳纤维限制Ni和NaCl晶粒的体积膨胀,结果表明,充放电50次循环后,它们的尺寸分别小于500 nm和7 µm,大大提高了电池的容量和循环寿命.此外,该复合正极在338 mA/g的高电流下,充放电循环350次后容量没有明显减少.随后,Li等[49 ] 设计了一种3D结构正极,其由碳纤维(CF)和多壁碳纳米管(MWCNT)作为导电基体,Ni以及NaCl颗粒均匀地分布在结构之中[图7 (b)].通过3D碳基体的分层结构抑制Ni和NaCl正极颗粒的长大.经过170圈循环后,电池容量仍保持在90 mAh/g.最近,中国科学院上海硅酸盐研究所温兆银研究员等[50 ] 结合Zebra电池的正极颗粒特征、长循环性能曲线与放电电压弛豫曲线进行了分析,得到Zebra电池将经历前期活化、中期稳定和后期性能老化等3个不同的性能阶段.通过观察电池的电压弛豫曲线的变化,可以较好地判断电池性能所处的阶段,从而获取电池的健康状态.并以此判断为基础,通过改变阴极的组成可减少电池活化时间,达到保持电池长循环稳定性的目的. ...
1
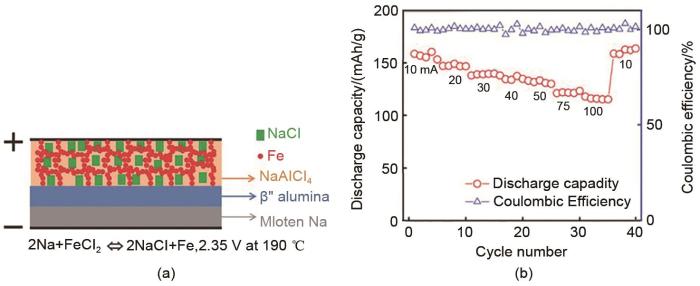
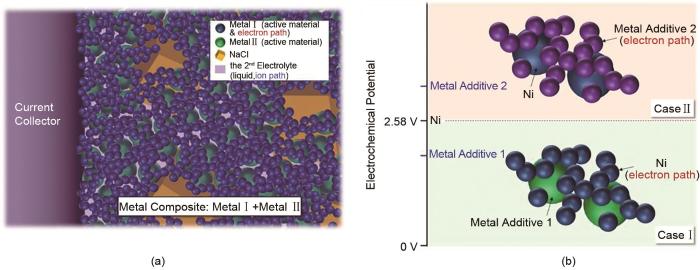
... 我国铁资源储量丰富,居世界第9位,广泛分布于全国31个省市.因此,将铁基电极材料应用于钠-氯化物电池对降低其成本具有现实意义.FeCl2 作为正极应用在熔融钠金属电池的报道最早出现在1986年(图8 )[44 ] ,其运行温度约为250 ℃,开路电压为2.35 V.2015年,Li等[51 ] 设计了一种新型钠-氯化亚铁(Na-FeCl2 )电池,首次在FeCl2 正极中使用少量的S作为正极添加剂,使Na-FeCl2 电池可以在<200 ℃下运行,并且电池具有快速充电能力.2016年,Ahn等[52 ] 提出了一种镍-铁复合材料的微观结构(图9 ),其中Ni作为添加剂.当Ni颗粒粒径大于Fe颗粒时,Fe颗粒会聚集在Ni颗粒之上,在正极中形成了紧凑且均匀的形貌.这不仅降低了电池成本,还兼顾了优异的循环性能,充放电100次循环后,Na-(Ni/Fe)Cl2 电池容量保持率约为65%,远高于Zebra电池(容量保持率约为40%).最近,Zhan等[53 ] 进一步设计了一种可以在190 ℃下运行的Na-FeCl2 电池(少量Ni作为添加剂).在33.3 mA/cm2 的电流密度下,该正极具有116 mAh/g的比容量.在电流密度10 mA/cm2 条件下,电池放电能量密度超过295 Wh/kg.并且,研究明确指出FeCl2 正极中少量(摩尔分数10%)的Ni作为添加剂,可以有效减轻电池过充(形成不可逆的FeCl3 )而造成铁颗粒粉碎引发的电池的容量衰减.虽然正极仍使用少量Ni,但FeCl2 作为主要正极活性物质有效降低了Zebra电池成本. ...
1
... 我国铁资源储量丰富,居世界第9位,广泛分布于全国31个省市.因此,将铁基电极材料应用于钠-氯化物电池对降低其成本具有现实意义.FeCl2 作为正极应用在熔融钠金属电池的报道最早出现在1986年(图8 )[44 ] ,其运行温度约为250 ℃,开路电压为2.35 V.2015年,Li等[51 ] 设计了一种新型钠-氯化亚铁(Na-FeCl2 )电池,首次在FeCl2 正极中使用少量的S作为正极添加剂,使Na-FeCl2 电池可以在<200 ℃下运行,并且电池具有快速充电能力.2016年,Ahn等[52 ] 提出了一种镍-铁复合材料的微观结构(图9 ),其中Ni作为添加剂.当Ni颗粒粒径大于Fe颗粒时,Fe颗粒会聚集在Ni颗粒之上,在正极中形成了紧凑且均匀的形貌.这不仅降低了电池成本,还兼顾了优异的循环性能,充放电100次循环后,Na-(Ni/Fe)Cl2 电池容量保持率约为65%,远高于Zebra电池(容量保持率约为40%).最近,Zhan等[53 ] 进一步设计了一种可以在190 ℃下运行的Na-FeCl2 电池(少量Ni作为添加剂).在33.3 mA/cm2 的电流密度下,该正极具有116 mAh/g的比容量.在电流密度10 mA/cm2 条件下,电池放电能量密度超过295 Wh/kg.并且,研究明确指出FeCl2 正极中少量(摩尔分数10%)的Ni作为添加剂,可以有效减轻电池过充(形成不可逆的FeCl3 )而造成铁颗粒粉碎引发的电池的容量衰减.虽然正极仍使用少量Ni,但FeCl2 作为主要正极活性物质有效降低了Zebra电池成本. ...
1
... 我国铁资源储量丰富,居世界第9位,广泛分布于全国31个省市.因此,将铁基电极材料应用于钠-氯化物电池对降低其成本具有现实意义.FeCl2 作为正极应用在熔融钠金属电池的报道最早出现在1986年(图8 )[44 ] ,其运行温度约为250 ℃,开路电压为2.35 V.2015年,Li等[51 ] 设计了一种新型钠-氯化亚铁(Na-FeCl2 )电池,首次在FeCl2 正极中使用少量的S作为正极添加剂,使Na-FeCl2 电池可以在<200 ℃下运行,并且电池具有快速充电能力.2016年,Ahn等[52 ] 提出了一种镍-铁复合材料的微观结构(图9 ),其中Ni作为添加剂.当Ni颗粒粒径大于Fe颗粒时,Fe颗粒会聚集在Ni颗粒之上,在正极中形成了紧凑且均匀的形貌.这不仅降低了电池成本,还兼顾了优异的循环性能,充放电100次循环后,Na-(Ni/Fe)Cl2 电池容量保持率约为65%,远高于Zebra电池(容量保持率约为40%).最近,Zhan等[53 ] 进一步设计了一种可以在190 ℃下运行的Na-FeCl2 电池(少量Ni作为添加剂).在33.3 mA/cm2 的电流密度下,该正极具有116 mAh/g的比容量.在电流密度10 mA/cm2 条件下,电池放电能量密度超过295 Wh/kg.并且,研究明确指出FeCl2 正极中少量(摩尔分数10%)的Ni作为添加剂,可以有效减轻电池过充(形成不可逆的FeCl3 )而造成铁颗粒粉碎引发的电池的容量衰减.虽然正极仍使用少量Ni,但FeCl2 作为主要正极活性物质有效降低了Zebra电池成本. ...
1
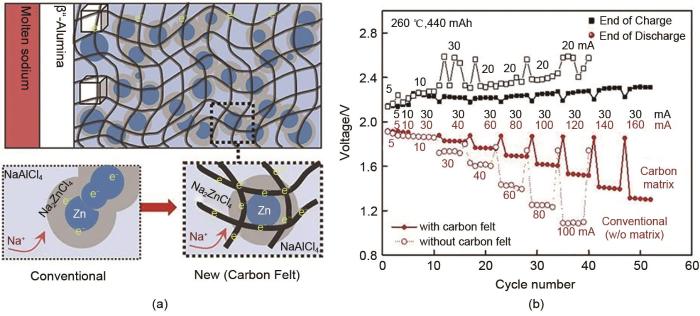
... 对于钠-氯化物电池的正极活性元素,研究者不仅仅将目光放在镍与铁上.Lu等[54 ] 在2013年提出了一种新型低成本Na-ZnCl2 电池,其工作温度为250~280 ℃,电池正极由Zn、NaCl以及熔融的NaAlCl4 电解质组成.在充电的第一阶段,正极NaCl与Zn反应形成Na2 ZnCl4 .当所有的NaCl被消耗掉,Na2 ZnCl4 和Zn之间进一步反应,形成NaCl-ZnCl2 共晶相,而后NaCl-ZnCl2 共晶相与Zn进一步反应生成固体ZnCl2 .作者将电池在20%~90%荷电状态(110 mAh)下进行30 mA的恒电流充放电测试,结果显示充放电过程中电池极化无明显增大,证明了Na-ZnCl2 电池的稳定电化学性能.2019年,Lee等[55 ] 在Na-ZnCl2 电池中使用较便宜的碳毡作为电子导电框架.与传统电池相比,220 mAh(1.37 V)和400 mAh(1.61 V)新型Na/ZnCl2 电池的放电终止电压分别提高了15%和50%,并且在160 mA放电电流下,220 mAh电池的总电荷转移电阻在第51圈循环时显著降低了62%,这种趋势在高容量(440 mAh)电池中更为明显.在260 ℃下与传统Na/ZnCl2 电池相比,新型Na/ZnCl2 电池表现出更好的倍率性能和循环稳定性(图10 ). ...
1
... 对于钠-氯化物电池的正极活性元素,研究者不仅仅将目光放在镍与铁上.Lu等[54 ] 在2013年提出了一种新型低成本Na-ZnCl2 电池,其工作温度为250~280 ℃,电池正极由Zn、NaCl以及熔融的NaAlCl4 电解质组成.在充电的第一阶段,正极NaCl与Zn反应形成Na2 ZnCl4 .当所有的NaCl被消耗掉,Na2 ZnCl4 和Zn之间进一步反应,形成NaCl-ZnCl2 共晶相,而后NaCl-ZnCl2 共晶相与Zn进一步反应生成固体ZnCl2 .作者将电池在20%~90%荷电状态(110 mAh)下进行30 mA的恒电流充放电测试,结果显示充放电过程中电池极化无明显增大,证明了Na-ZnCl2 电池的稳定电化学性能.2019年,Lee等[55 ] 在Na-ZnCl2 电池中使用较便宜的碳毡作为电子导电框架.与传统电池相比,220 mAh(1.37 V)和400 mAh(1.61 V)新型Na/ZnCl2 电池的放电终止电压分别提高了15%和50%,并且在160 mA放电电流下,220 mAh电池的总电荷转移电阻在第51圈循环时显著降低了62%,这种趋势在高容量(440 mAh)电池中更为明显.在260 ℃下与传统Na/ZnCl2 电池相比,新型Na/ZnCl2 电池表现出更好的倍率性能和循环稳定性(图10 ). ...
1
... 此外,高温是限制钠-氯化物电池规模应用的一大难题.为了保证金属钠的液态特征和固态电解质的离子传导性能,此类电池工作需要保持在300 ℃上下的运行温度,同样需要控温装置辅助,电池的运行成本和场地要求较室温电池高.因此,如何将钠-氯化物电池工作温度降至中温(120~300 ℃)甚至室温区间是目前研究的重点方向之一.降低电池的操作温度的关键是如何在保证较低的操作温度下,电极及电解质中依然具有较高的Na+ 电导率.Li等[56 ] 用NaBr等低熔点碱金属盐部分取代NaAlCl4 中的NaCl,在较低的温度下具有较好的离子导电性和足够的电化学稳定性,含有NaBr正极电解质的电池在150 ℃下表现出稳定的性能,这个温度远远低于一般Zebra电池的工作温度(300 ℃). ...
1
... 2015年,Kim等[57 ] 基于钠离子快离子导体(NA-SICON)固体电解质,成功设计出可在195 ℃下正常运行的新型Zebra电池.他们发现得益于NA-SICON的高Na+ 离子电导率,在相同的扫描速率下(5 mV/s)和运行温度(180 ℃)下,使用NA-SICON的电池(N-Cell)比使用常规的β"-Al2 O3 固体电解质电池(β-Cell)拥有更大Ni/Ni2+ 氧化还原电流(即更快的Ni/Ni2+ 反应动力学)[图11 (a)].此外,在9.6 Ah全电池高电流密度充放电过程中(充/放电流密度为50/100 mA/cm2 ,运行温度195 ℃),N-Cell比β-Cell具有更小的过电位和电化学极化[图11 (b)],进而显著提高了电池的能量效率(表3 ).此外,N-Cell的充电容量利用率只有82.7%,是传统β-Cell(28.8%)的3倍. ...