[1]
YE Z C, QIU L, YANG W, et al. Nickel-rich layered cathode materials for lithium-ion batteries[J]. Chemistry (Weinheim an Der Bergstrasse, Germany), 2021, 27(13): 4249-4269.
[本文引用: 1]
[2]
SUN Y K, MYUNG S T, PARK B C, et al. High-energy cathode material for long-life and safe lithium batteries[J]. Nature Materials, 2009, 8(4): 320-324.
[3]
SUN Y K, CHEN Z H, NOH H J, et al. Nanostructured high-energy cathode materials for advanced lithium batteries[J]. Nature Materials, 2012, 11(11): 942-947.
[4]
SUN H H, KIM U H, PARK J H, et al. Transition metal-doped Ni-rich layered cathode materials for durable Li-ion batteries[J]. Nature Communications, 2021, 12: doi: 10.1038/s41467-021-26815-6.
[5]
MYUNG S T, MAGLIA F, PARK K J, et al. Nickel-rich layered cathode materials for automotive lithium-ion batteries: Achievements and perspectives[J]. ACS Energy Letters, 2017, 2(1): 196-223.
[6]
KIM J, LEE H, CHA H, et al. Prospect and reality of Ni-rich cathode for commercialization[J]. Advanced Energy Materials, 2018, 8(6): doi: 10.1002/aenm.201702028.
[本文引用: 1]
[7]
LU L G, HAN X B, LI J Q, et al. A review on the key issues for lithium-ion battery management in electric vehicles[J]. Journal of Power Sources, 2013, 226: 272-288.
[本文引用: 1]
[8]
ZUBI G, DUFO-LÓPEZ R, CARVALHO M, et al. The lithium-ion battery: State of the art and future perspectives[J]. Renewable and Sustainable Energy Reviews, 2018, 89: 292-308.
[9]
KIM U H, PARK J H, AISHOVA A, et al. Microstructure engineered Ni-rich layered cathode for electric vehicle batteries[J]. Advanced Energy Materials, 2021, 11(25): doi: 10.1002/aenm.202100884.
[10]
SONG L B, DU J L, XIAO Z L, et al. Research progress on the surface of high-nickel nickel-cobalt-Manganese ternary cathode materials: A mini review[J]. Frontiers in Chemistry, 2020, 8: doi: 10.3389/fchem.2020.00761.
[本文引用: 1]
[11]
陈绍军, 丁波, 丁安莉, 等. Na+ 掺杂对LiNi0.8 Co0.1 Mn0.1 O2 正极材料电化学性能的影响[J]. 材料科学与工程学报, 2021, 39(5): 843-846.
[本文引用: 2]
CHEN S J, DING B, DING A L, et al. Effect of Na+ doping on electrochemical properties of Lini0.8 Co0.1 Mn0.1 O2 improved by doping sodium ions[J]. Journal of Materials Science and Engineering, 2021, 39(5): 843-846.
[本文引用: 2]
[12]
LI M, LU J. Cobalt in lithium-ion batteries[J]. Science, 2020, 367(6481): 979-980.
[本文引用: 1]
[13]
YU H J, QIAN Y M, OTANI M, et al. Study of the lithium/nickel ions exchange in the layered LiNi0.42 Mn0.42 Co0.16 O2 cathode material for lithium ion batteries: Experimental and first-principles calculations[J]. Energy & Environmental Science, 2014, 7(3): 1068-1078.
[本文引用: 1]
[14]
GILBERT J A, SHKROB I A, ABRAHAM D P. Transition metal dissolution, ion migration, electrocatalytic reduction and capacity loss in lithium-ion full cells[J]. Journal of the Electrochemical Society, 2017, 164(2): doi: 10.1149/2.1111702jes.
[本文引用: 1]
[15]
HUANG B, LI X H, WANG Z X, et al. Synthesis of Mg-doped LiNi0.8 Co0.15 Al0.05 O2 oxide and its electrochemical behavior in high-voltage lithium-ion batteries[J]. Ceramics International, 2014, 40(8): 13223-13230.
[本文引用: 1]
[16]
SUSAI F A, KOVACHEVA D, CHAKRABORTY A, et al. Improving performance of LiNi0.8 Co0.1 Mn0.1 O2 cathode materials for lithium-ion batteries by doping with molybdenum-ions: Theoretical and experimental studies[J]. ACS Applied Energy Materials, 2019, 2(6): 4521-4534.
[本文引用: 1]
[17]
ZHANG D K, LIU Y, WU L, et al. Effect of Ti ion doping on electrochemical performance of Ni-rich LiNi0.8 Co0.1 Mn0.1 O2 cathode material[J]. Electrochimica Acta, 2019, 328: doi: 10.1016/j.electacta.2019.135086.
[本文引用: 1]
[18]
HE T, LU Y, SU Y F, et al. Sufficient utilization of zirconium ions to improve the structure and surface properties of nickel-rich cathode materials for lithium-ion batteries[J]. ChemSusChem, 2018, 11(10): 1639-1648.
[本文引用: 1]
[19]
KIM U H, JUN D W, PARK K J, et al. Pushing the limit of layered transition metal oxide cathodes for high-energy density rechargeable Li ion batteries[J]. Energy & Environmental Science, 2018, 11(5): 1271-1279.
[本文引用: 1]
[20]
LEI Y K, AI J J, YANG S, et al. Nb-doping in LiNi0.8 Co0.1 Mn0.1 O2 cathode material: Effect on the cycling stability and voltage decay at high rates[J]. Journal of the Taiwan Institute of Chemical Engineers, 2019, 97: 255-263.
[本文引用: 1]
[21]
LI L J, WANG Z X, LIU Q C, et al. Effects of chromium on the structural, surface chemistry and electrochemical of layered LiNi0.8- x Co0.1 Mn0.1 Crx O2 [J]. Electrochimica Acta, 2012, 77: 89-96.
[本文引用: 1]
[22]
ZHANG M Y, WANG C Y, ZHANG J K, et al. Preparation and electrochemical characterization of La and Al Co-doped NCM811 cathode materials[J]. ACS Omega, 2021, 6(25): 16465-16471.
[本文引用: 1]
[23]
LIU X L, WANG S, WANG L, et al. Stabilizing the high-voltage cycle performance of LiNi0.8 Co0.1 Mn0.1 O2 cathode material by Mg doping[J]. Journal of Power Sources, 2019, 438: doi: 10.1016/j.jpowsour.2019.227017.
[本文引用: 4]
[24]
HUANG Z J, WANG Z X, GUO H J, et al. Influence of Mg2+ doping on the structure and electrochemical performances of layered LiNi0.6 Co0.2- x Mn0.2 Mgx O2 cathode materials[J]. Journal of Alloys and Compounds, 2016, 671: 479-485.
[本文引用: 2]
[25]
SATTAR T, LEE S H, SIM S J, et al. Effect of Mg-doping on the electrochemical performance of LiNi0.84 Co0.11 Mn0.05 O2 cathode for lithium ion batteries[J]. International Journal of Hydrogen Energy, 2020, 45(38): 19567-19576.
[本文引用: 6]
[26]
赵航, 魏闯, 康鑫, 等. 锂离子电池三元正极材料的研究进展[J]. 中国陶瓷, 2020, 56(5): 10-15.
[本文引用: 4]
ZHAO H, WEI C, KANG X, et al. Research progress of ternary cathode materials for lithium ion battery[J]. China Ceramics, 2020, 56(5): 10-15.
[本文引用: 4]
[27]
LIU B S, SUI X L, ZHANG S H, et al. Investigation on electrochemical performance of LiNi0.8 Co0.15 Al0.05 O2 coated by heterogeneous layer of TiO2 [J]. Journal of Alloys and Compounds, 2018, 739: 961-971.
[本文引用: 1]
[28]
GAN Z G, HU G R, PENG Z D, et al. Surface modification of LiNi0.8 Co0.1 Mn0.1 O2 by WO3 as a cathode material for LIB[J]. Applied Surface Science, 2019, 481: 1228-1238.
[本文引用: 2]
[29]
YAO L, LIANG F Q, JIN J, et al. Improved electrochemical property of Ni-rich LiNi0.6 Co0.2 Mn0.2 O2 cathode via in situ ZrO2 coating for high energy density lithium ion batteries[J]. Chemical Engineering Journal, 2020, 389: doi: 10.1016/j.cej.2020.124403.
[本文引用: 1]
[30]
NEUDECK S, STRAUSS F, GARCIA G, et al. Room temperature, liquid-phase Al2 O3 surface coating approach for Ni-rich layered oxide cathode material[J]. Chemical Communications (Cambridge, England), 2019, 55(15): 2174-2177.
[本文引用: 1]
[31]
LI Y J, ZHU J, DENG S Y, et al. Towards superior cyclability of LiNi0.8 Co0.1 Mn0.1 O2 cathode material for lithium ion batteries via synergetic effects of Sb modification[J]. Journal of Alloys and Compounds, 2019, 798: 93-103.
[本文引用: 1]
[32]
HEMMELMANN H, DINTER J K, ELM M T. Thin film NCM cathodes as model systems to assess the influence of coating layers on the electrochemical performance of lithium ion batteries[J]. Advanced Materials Interfaces, 2021, 8(9): doi: 10.1002/admi.202002074.
[本文引用: 1]
[33]
ZHAO L N, CHEN G R, WENG Y H, et al. Precise Al2 O3 coating on LiNi0.5 Co0.2 Mn0.3 O2 by atomic layer deposition restrains the shuttle effect of transition metals in Li-ion capacitors[J]. Chemical Engineering Journal, 2020, 401: doi: 10.1016/j.cej.2020.126138.
[本文引用: 1]
[34]
GAO S, WANG L J, ZHOU C Y, et al. In-situ construction protective layer and phosphate doping synergistically improve the long-term cycle stability of LiNi0.6 Co0.1 Mn0.3 O2 [J]. Chemical Engineering Journal, 2021, 426: doi: 10.1016/j.cej.2021.131359.
[本文引用: 1]
[35]
LI Y C, XIANG W, XIAO Y, et al. Synergy of doping and coating induced heterogeneous structure and concentration gradient in Ni-rich cathode for enhanced electrochemical performance[J]. Journal of Power Sources, 2019, 423: 144-151.
[本文引用: 1]
[36]
YU H F, ZHU H W, YANG Z F, et al. Bulk Mg-doping and surface polypyrrole-coating enable high-rate and long-life for Ni-rich layered cathodes[J]. Chemical Engineering Journal, 2021, 412: doi: 10.1016/j.cej.2021.128625.
[本文引用: 1]
[37]
YANG G C, PAN K, LAI F Y, et al. Integrated co-modification of PO 4 3 - 2 TiO3 coating for Ni-rich layered LiNi0.6 Co0.2 Mn0.2 O2 cathode material of Lithium-Ion batteries[J]. Chemical Engineering Journal, 2021, 421: doi: 10.1016/j.cej.2021.129964.
[本文引用: 1]
[38]
SHEN J X, DENG D, LI X, et al. Realizing ultrahigh-voltage performance of single-crystalline LiNi0.55 Co0.15 Mn0.3 O2 cathode materials by simultaneous Zr-doping and B2 O3 -coating[J]. Journal of Alloys and Compounds, 2022, 903: doi: 10.1016/j.jallcom. 2022.163999.
[本文引用: 1]
[39]
倪闯将, 刘亚飞, 陈彦彬, 等. 镍钴锰三元材料的结构及改性研究进展[J]. 电源技术, 2021, 45(1): 123-126.
[本文引用: 1]
NI C J, LIU Y F, CHEN Y B, et al. Research progress of structure and modification of Li(Nix Coy Mnz )O2 ternary materials[J]. Chinese Journal of Power Sources, 2021, 45(1): 123-126.
[本文引用: 1]
[40]
HUANG B, WANG M, ZHAO Z Y, et al. Effects of the strong oxidant treatment of precursor on the electrochemical properties of LiNi0.8 Mn0.1 Co0.1 O2 for lithium-ion batteries[J]. Journal of Alloys and Compounds, 2019, 810: doi: 10.1016/j.jallcom.2019.151800.
[本文引用: 1]
[41]
芦志刚, 李延伟, 姜吉琼, 等. 不同锂源对高温固相法制备NCM811正极材料储锂性能的影响[J]. 稀有金属材料与工程, 2021, 50(10): 3757-3764.
[本文引用: 1]
LU Z G, LI Y W, JIANG J Q, et al. Influence of lithium sources on the lithium ion storage performance of NCM811 cathode materials prepared by high-temperature solid-state reaction method[J]. Rare Metal Materials and Engineering, 2021, 50(10): 3757-3764.
[本文引用: 1]
[42]
ZHANG R, WANG C Y, ZOU P C, et al. Compositionally complex doping for zero-strain zero-cobalt layered cathodes[J]. Nature, 2022, 610(7930): 67-73.
[本文引用: 1]
[43]
HUANG J, FANG X, WU Y N, et al. Enhanced electrochemical performance of LiNi0.8 Co0.1 Mn0.1 O2 by surface modification with lithium-active MoO3 [J]. Journal of Electroanalytical Chemistry, 2018, 823: 359-367.
[本文引用: 2]
[44]
LV Y T, CHENG X, QIANG W J, et al. Improved electrochemical performances of Ni-rich LiNi0.83 Co0.12 Mn0.05 O2 by Mg-doping[J]. Journal of Power Sources, 2020, 450: doi: 10.1016/j.jpowsour. 2020.227718.
[本文引用: 1]
[45]
LIU J, ZOU Z G, ZHONG S L, et al. Improved electrochemical performance of magnesium-doped LiNi0.8- x Mgx Co0.1 Mn0.1 O2 by CTAB-assisted solvothermal and calcining method[J]. Ionics, 2021, 27(4): 1501-1509.
[本文引用: 1]
[46]
ROITZHEIM C, KUO L Y, SOHN Y J, et al. Boron in Ni-rich NCM811 cathode material: Impact on atomic and microscale properties[J]. ACS Applied Energy Materials, 2022, 5(1): 524-538.
[本文引用: 1]
[47]
YAN W W, YANG S Y, HUANG Y Y, et al. A review on doping/coating of nickel-rich cathode materials for lithium-ion batteries[J]. Journal of Alloys and Compounds, 2020, 819: doi: 10.1016/j.jallcom.2019.153048.
[本文引用: 1]
[48]
ZAHRA A, KONG X Z, EKATERINA F, et al. Extensive comparison of doping and coating strategies for Ni-rich positive electrode materials[J]. Journal of Power Sources, 2022, 540: doi: 10.1016/j.jpowsour.2022.231633.
[本文引用: 1]
[49]
LI C, ZHANG H P, FU L J, et al. Cathode materials modified by surface coating for lithium ion batteries[J]. Electrochimica Acta, 2006, 51(19): 3872-3883.
[本文引用: 1]
[50]
HUANG Z J, WANG Z X, ZHENG X B, et al. Effect of Mg doping on the structural and electrochemical performance of LiNi0.6 Co0.2 Mn0.2 O2 cathode materials[J]. Electrochimica Acta, 2015, 182: 795-802.
[本文引用: 1]
[51]
XI X S, FAN Y Y, LIU Y C, et al. Enhanced cyclic stability of NCM-622 cathode by Ti3+ doped TiO2 coating[J]. Journal of Alloys and Compounds, 2021, 872: doi: 10.1016/j.jallcom.2021.159664.
[本文引用: 1]
[52]
RENFREW S E, MCCLOSKEY B D. Residual lithium carbonate predominantly accounts for first cycle CO2 and CO outgassing of Li-stoichiometric and Li-rich layered transition-metal oxides[J]. Journal of the American Chemical Society, 2017, 139(49): 17853-17860.
[本文引用: 1]
[53]
BETTGE M, LI Y, SANKARAN B, et al. Improving high-capacity Li1.2 Ni0.15 Mn0.55 Co0.1 O2 -based lithium-ion cells by modifiying the positive electrode with alumina[J]. Journal of Power Sources, 2013, 233: 346-357.
[本文引用: 1]
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
2
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
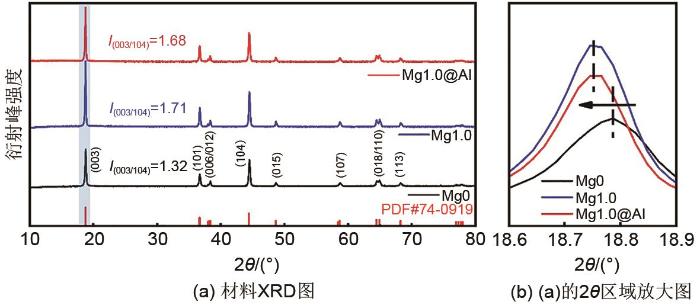
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
2
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 在不可再生能源日益减少和大气污染不断加剧的双重压力下,研究开发新型可再生能源和保护环境成为了当今世界的主题.锂离子电池因具有放电比容量高、循环性能良好、快速充放电、成本低、环境友好、使用寿命长等优点[1 -6 ] 广泛应用于新能源汽车、航空航天、医疗电子、数码产品等众多领域[7 -10 ] .随着科技不断地发展,能源的需求急剧增加,社会对锂离子电池的能量密度和生产成本要求日益增高.《中国制造2025》提出我国生产的锂离子动力电池能量密度的目标是2025年达到400 Wh/kg,2030年则要达到500 Wh/kg.目前电池的电化学性能主要受正极材料的限制,如常见商业锂电正极材料如镍酸锂(LiNiO2 )、钴酸锂(LiCoO2 )、锰酸锂(LiMnO2 )和磷酸铁锂(LiFePO4 )等因能量密度较低,倍率循环性能较差等,逐渐无法满足对新能源的日常需求[11 ] .以LiNi0.8 Co0.1 Mn0.1 O2 (NCM811)为代表的高镍三元材料因具有较高放电比容量(约270 mAh/g)、优异倍率性能和成本低廉等优点,能够满足新能源汽车对动力电池续航需求,是现阶段极具发展潜力的锂离子电池正极材料.研究发现层状三元材料NCM中的Ni2+ 可提供较高的比容量;Co3+ 在过渡金属层中充当缓冲原子,能有效抑制Ni2+ 阳离子的磁矩,从而抑制锂镍混排[12 ] ;Mn离子代替一部分Co离子,降低材料成本、加固材料层状空间,稳定材料的空间结构,大幅提升了电池的安全性能.然而,高镍三元材料在商业应用中仍存在一系列问题,主要是由于Ni2+ (0.69 Å)与Li+ (0.76 Å)的离子半径相近,过渡金属层中的部分Ni2+ 在高温煅烧过程中会占据锂离子空位,形成阳离子混乱排序,对材料在长期循环过程中的电化学性能造成严重衰减[13 ] .此外,材料表面中起稳定结构作用的Mn2+ 易与电解液发生歧化反应[14 ] ,导致材料结构稳定性下降,循环性能变差,易造成安全性问题.因此,如何提升高镍NCM811材料的电化学性能是未来动力锂离子电池主流研究方向之一. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
4
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
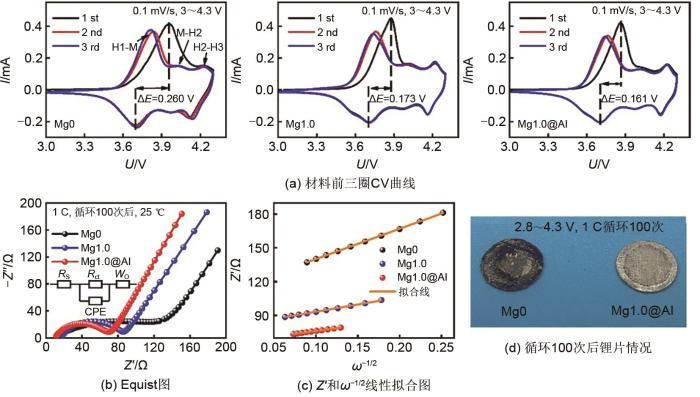
... 本研究所有电化学测试的电池均是以锂片为对电极的半电池体系(Li || NCM811),图4 (a)为Mg0、Mg1.0和Mg1.0@Al材料在0.1 mV/s、电压范围3~4.3 V下循环前三次的循环伏安(CV)曲线.曲线中出现由相转变引起的三对氧化还原峰,从低压区到高压区,分别为六方相到单斜相(H1-M),单斜相到六方相(M-H2)和六方相到六方相(H2-H3)[42 ] .首次循环中氧化峰电位发生偏移是由于首次充电过程中电解液与活性材料发生不可逆反应生成固体电解质界面(SEI)膜导致的,其氧化还原峰之间的电位差(ΔE )代表了电极极化,极化越小说明材料的循环和倍率性能优异[24 ] .Mg0材料在首次ΔE 为0.260 V,掺杂Mg后,材料电位差下降至0.173 V,这是由于Mg—O键能够稳定材料结构,并且掺杂Mg有效地缓解了材料阳离子混乱程度,因而表现出较低的电位差[25 ] .Mg1.0@Al材料首次ΔE 为0.161 V,电位差较Mg1.0材料明显下降,这归因于Al2 O3 涂层有效抑制了副反应的发生,进一步稳定材料结构,减少了不可逆容量[23 ] .同时,Mg1.0@Al材料第二、第三次循环曲线重合度较高,说明Mg1.0@Al材料具有良好的可逆性. ...
... 进一步测试材料1 C下循环100次后的电化学稳定性[图5 (c)、5 (d)],观察到随着充放电次数的增加,材料放电中压不断下降[图5 (c)].Mg0材料的电压差(ΔV )为87.8 mV,改性后,Mg1.0材料的ΔV 为25.6 mV,明显比Mg0材料具有更稳定的放电电压,这是由于Mg—O键的存在,使得材料结构在充放电过程中能够保持稳定[26 ] .同时,Mg1.0@Al材料较Mg1.0材料表现出更稳定的放电中压(ΔV =5.2 mV),这归因于Al2 O3 涂层对材料表面的保护,进一步稳定材料的结构[23 ] .循环稳定性测试显示[图5 (d)],Mg0材料的放电比容量和容量保持率分别为114.51 mAh/g和73.66%;改性后,Mg1.0材料的循环稳定性明显上升,放电比容量和容量保持率分别为164.20 mAh/g和88.01%,进一步证明Mg—O键能够稳定材料结构[26 ] .同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
2
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... 本研究所有电化学测试的电池均是以锂片为对电极的半电池体系(Li || NCM811),图4 (a)为Mg0、Mg1.0和Mg1.0@Al材料在0.1 mV/s、电压范围3~4.3 V下循环前三次的循环伏安(CV)曲线.曲线中出现由相转变引起的三对氧化还原峰,从低压区到高压区,分别为六方相到单斜相(H1-M),单斜相到六方相(M-H2)和六方相到六方相(H2-H3)[42 ] .首次循环中氧化峰电位发生偏移是由于首次充电过程中电解液与活性材料发生不可逆反应生成固体电解质界面(SEI)膜导致的,其氧化还原峰之间的电位差(ΔE )代表了电极极化,极化越小说明材料的循环和倍率性能优异[24 ] .Mg0材料在首次ΔE 为0.260 V,掺杂Mg后,材料电位差下降至0.173 V,这是由于Mg—O键能够稳定材料结构,并且掺杂Mg有效地缓解了材料阳离子混乱程度,因而表现出较低的电位差[25 ] .Mg1.0@Al材料首次ΔE 为0.161 V,电位差较Mg1.0材料明显下降,这归因于Al2 O3 涂层有效抑制了副反应的发生,进一步稳定材料结构,减少了不可逆容量[23 ] .同时,Mg1.0@Al材料第二、第三次循环曲线重合度较高,说明Mg1.0@Al材料具有良好的可逆性. ...
6
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... [25 ].表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
... [25 ],证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
... 本研究所有电化学测试的电池均是以锂片为对电极的半电池体系(Li || NCM811),图4 (a)为Mg0、Mg1.0和Mg1.0@Al材料在0.1 mV/s、电压范围3~4.3 V下循环前三次的循环伏安(CV)曲线.曲线中出现由相转变引起的三对氧化还原峰,从低压区到高压区,分别为六方相到单斜相(H1-M),单斜相到六方相(M-H2)和六方相到六方相(H2-H3)[42 ] .首次循环中氧化峰电位发生偏移是由于首次充电过程中电解液与活性材料发生不可逆反应生成固体电解质界面(SEI)膜导致的,其氧化还原峰之间的电位差(ΔE )代表了电极极化,极化越小说明材料的循环和倍率性能优异[24 ] .Mg0材料在首次ΔE 为0.260 V,掺杂Mg后,材料电位差下降至0.173 V,这是由于Mg—O键能够稳定材料结构,并且掺杂Mg有效地缓解了材料阳离子混乱程度,因而表现出较低的电位差[25 ] .Mg1.0@Al材料首次ΔE 为0.161 V,电位差较Mg1.0材料明显下降,这归因于Al2 O3 涂层有效抑制了副反应的发生,进一步稳定材料结构,减少了不可逆容量[23 ] .同时,Mg1.0@Al材料第二、第三次循环曲线重合度较高,说明Mg1.0@Al材料具有良好的可逆性. ...
... 图4 (b)为Mg0、Mg1.0和Mg1.0@Al材料在1 C下循环100次后的交流阻抗(EIS)图,其由高频区域的半圆和低频区的斜线两部分组成.插图为材料EIS曲线的等效电路模型,R s 表示存在于工作电极和参比电极之间的内部欧姆电阻;CPE为电极/电解质之间的电容;R ct 表示电荷转移阻抗,代表样品颗粒表面上Li+ 传输的界面反应的电荷转移阻力;W o 代表Warburg阻抗,显示Li+ 在电极中的迁移速率[43 ] .通过Zview软件拟合得到各元件数值(表1 ),Mg0、Mg1.0和Mg1.0@Al三个材料在经过100次循环后,欧姆阻抗(R s )分别为8.55 Ω、16.55 Ω和10.00 Ω,改性前后材料R s 相似,表明测试条件一致[44 ] .Mg0材料的电荷转移阻抗R ct 为113.70 Ω,掺杂Mg后,Mg1.0材料的电荷转移阻抗值(R ct =66.37 Ω)明显缩减,因为Mg掺杂能够提高材料的化学稳定性,形成稳定的SEI膜[25 ,45 ] ;同时观察到Mg1.0@Al材料的R ct 为51.66 Ω,比Mg1.0材料略低,表明涂层有效防止电解液对材料表面的腐蚀,进一步稳定材料结构[43 ] .图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
4
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... Mg1.0材料的D Li 计算值为2.46×10-14 cm2 /s,约为未改性Mg0材料(D Li =5.62×10-15 cm2 /s)的6.64倍,这归因于Mg离子取代Mn离子位点,扩大了材料晶胞,拓宽锂层间距,有利于Li+ 的脱嵌,增加材料的导电性[26 ] .Mg1.0@Al的D Li 为4.05×10-14 cm2 /s,约为Mg1.0材料的1.65倍、Mg0材料的7.21倍,说明在不断的充放电过程中,Al2 O3 涂覆层有效地抑制NCM811材料表面与电解液之间的副反应,稳定材料结构,为Li+ 提供了稳定的传输通道,使得NCM811材料表现出优异的锂离子扩散系数[47 -48 ] .图4 (d)显示了Mg0和Mg1.0@Al材料在2.8~4.3 V下,1 C循环100次后锂片表面情况,明显观察到锂片表面变黑,这是由于NCM811材料中Mn的溶解,变成黑色的Mn4+ 固体化合物[49 ] ,穿过隔膜附着在锂片上.改性后的Mg1.0@Al材料较未改性的Mg0材料在经历长循环后,锂片表面黑色物质明显较少,表明Al2 O3 涂层能够有效抑制NCM811材料表面与电解液之间的副反应,有效缓解Mn2+ 溶解. ...
... 进一步测试材料1 C下循环100次后的电化学稳定性[图5 (c)、5 (d)],观察到随着充放电次数的增加,材料放电中压不断下降[图5 (c)].Mg0材料的电压差(ΔV )为87.8 mV,改性后,Mg1.0材料的ΔV 为25.6 mV,明显比Mg0材料具有更稳定的放电电压,这是由于Mg—O键的存在,使得材料结构在充放电过程中能够保持稳定[26 ] .同时,Mg1.0@Al材料较Mg1.0材料表现出更稳定的放电中压(ΔV =5.2 mV),这归因于Al2 O3 涂层对材料表面的保护,进一步稳定材料的结构[23 ] .循环稳定性测试显示[图5 (d)],Mg0材料的放电比容量和容量保持率分别为114.51 mAh/g和73.66%;改性后,Mg1.0材料的循环稳定性明显上升,放电比容量和容量保持率分别为164.20 mAh/g和88.01%,进一步证明Mg—O键能够稳定材料结构[26 ] .同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
... [26 ].同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
4
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... Mg1.0材料的D Li 计算值为2.46×10-14 cm2 /s,约为未改性Mg0材料(D Li =5.62×10-15 cm2 /s)的6.64倍,这归因于Mg离子取代Mn离子位点,扩大了材料晶胞,拓宽锂层间距,有利于Li+ 的脱嵌,增加材料的导电性[26 ] .Mg1.0@Al的D Li 为4.05×10-14 cm2 /s,约为Mg1.0材料的1.65倍、Mg0材料的7.21倍,说明在不断的充放电过程中,Al2 O3 涂覆层有效地抑制NCM811材料表面与电解液之间的副反应,稳定材料结构,为Li+ 提供了稳定的传输通道,使得NCM811材料表现出优异的锂离子扩散系数[47 -48 ] .图4 (d)显示了Mg0和Mg1.0@Al材料在2.8~4.3 V下,1 C循环100次后锂片表面情况,明显观察到锂片表面变黑,这是由于NCM811材料中Mn的溶解,变成黑色的Mn4+ 固体化合物[49 ] ,穿过隔膜附着在锂片上.改性后的Mg1.0@Al材料较未改性的Mg0材料在经历长循环后,锂片表面黑色物质明显较少,表明Al2 O3 涂层能够有效抑制NCM811材料表面与电解液之间的副反应,有效缓解Mn2+ 溶解. ...
... 进一步测试材料1 C下循环100次后的电化学稳定性[图5 (c)、5 (d)],观察到随着充放电次数的增加,材料放电中压不断下降[图5 (c)].Mg0材料的电压差(ΔV )为87.8 mV,改性后,Mg1.0材料的ΔV 为25.6 mV,明显比Mg0材料具有更稳定的放电电压,这是由于Mg—O键的存在,使得材料结构在充放电过程中能够保持稳定[26 ] .同时,Mg1.0@Al材料较Mg1.0材料表现出更稳定的放电中压(ΔV =5.2 mV),这归因于Al2 O3 涂层对材料表面的保护,进一步稳定材料的结构[23 ] .循环稳定性测试显示[图5 (d)],Mg0材料的放电比容量和容量保持率分别为114.51 mAh/g和73.66%;改性后,Mg1.0材料的循环稳定性明显上升,放电比容量和容量保持率分别为164.20 mAh/g和88.01%,进一步证明Mg—O键能够稳定材料结构[26 ] .同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
... [26 ].同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
2
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
... 扫描电子显微镜(SEM)显示掺杂和包覆前后材料的微观形貌,Mg0材料[图3 (a)]为1~10 μm的二次球形颗粒材料,插图高分辨SEM表明其主要由约为500 nm的一次颗粒聚集而成.掺杂Mg和包覆Al2 O3 后,材料颗粒形貌没有明显改变[图3 (b)、(c)],说明材料改性未对其形貌造成影响.Mg1.0@Al的高倍透射电镜(HRTEM)[图3 (d)]展示了包覆层的厚度约为9.55 nm,边缘区域的晶格条纹间距(0.203 nm)与Al2 O3 的(113)晶面条纹一致,表明Al2 O3 成功涂覆在材料表面上;颗粒中主体区域是晶格间距为0.247 nm的α -NaFeO2 相的(101)晶面,表明包覆改性未破坏材料晶体结构[28 ] .图3 (e)为Mg1.0@Al材料元素分布图(Mapping),Ni、Co、Mn、Mg四个元素分布均匀,进一步证明成功将Mg均匀掺杂到NCM811材料中;同时观察到Al元素的存在且分布均匀,表明Al2 O3 成功均匀地涂覆在材料表面. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
1
... 现今,改善高镍NCM材料电化学性能的主要途径有离子掺杂和表面包覆两种.Mg[15 ] 、Mo[16 ] 、Ti[17 ] 、Zr[18 ] 、W[19 ] 、Nb[20 ] 、Cr[21 ] 和镧铝共掺杂[22 ] 等离子掺杂被证明是优化高镍NCM材料电化学性能的有效策略;其中,镁元素地球储量丰富,成本较低,是经济效益最高的掺杂元素.研究人员已经通过液相法[23 ] 、共沉淀法[24 ] 、高温固相法[25 ] 等合成手段成功地将Mg元素掺杂进入高镍NCM材料中,发现由于Mg2+ 半径大于Li+ 半径,掺杂Mg能够扩大材料层间距,为锂离子脱嵌提供更宽通道,从而有效提升材料的导电性和锂离子扩散系数;同时Mg取代部分过渡金属,形成更稳定的Mg—O键,稳定材料层状结构,有助改善材料中阳离子混乱程度,提升材料高压循环性能和抑制循环过程中H2—H3相变,从而防止氧气的释放,有效提高材料的电化学性能[25 ] .表面包覆是在材料表面涂覆一层保护膜,防止材料与电解液发生副反应,提高材料稳定性[26 ] .现如今的包覆材料主要有:氧化物、氟化物和磷酸盐等;其中以氧化物为代表的TiO2 [27 ] 、WO3 [28 ] 、ZrO2 [29 ] 、Al2 O3 [30 ] 和Sb2 O3 [31 ] 等包覆材料中,Al2 O3 是成本最低,经济效益最高的表面包覆材料.Hemmelmann等[32 ] 通过溶胶凝胶法将Al2 O3 涂覆在NCM材料表面,发现Al2 O3 涂层有效地防止了Mn的溶解,防止材料被腐蚀和稳定材料结构,在长期循环过程中表现出优异的稳定性.Zhao等[33 ] 利用原子层沉积技术在NCM523材料表面涂覆Al2 O3 ,有效缓解循环过程中NCM材料颗粒的内应力,同时抑制电解液对材料表面的侵蚀,稳定材料结构,提高材料循环性能.总而言之,Al2 O3 涂层因成本低、能有效防止材料与电解液之间的副反应、稳定材料结构和显著改善材料循环稳定性而备受关注. ...
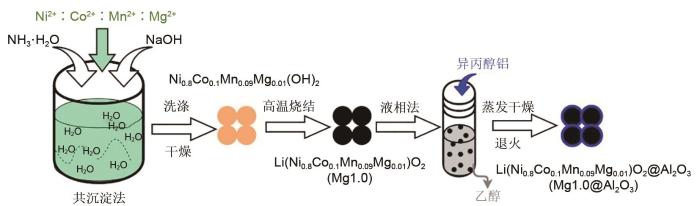
1
... 近年来,科研人员发现将结构掺杂与表面包覆结合形成的协同作用能够进一步提升高镍层状三元材料的电化学性能[34 -35 ] .Yu等[36 ] 通过在LiNi0.9 Co0.1 O2 材料上掺杂Mg和表面涂覆聚吡咯的双重改性策略,将镁离子充当柱状离子改善阳离子无序程度,疏通晶格中的Li+ 扩散通道;导电聚吡咯涂层增强固体电解质界面处的电荷转移,并有效防止表面副反应的发生,使得材料具有高倍率和长寿命.Yang等[37 ] 使用聚阴离子PO4 3 - 2 TiO3 包覆对NCM622材料进行集成改性,PO4 3 - 2 TiO3 涂层可抑制副反应并降低离子传输阻抗,使得材料在高截止电压(4.5 V)下表现出优异的倍率性能和循环稳定性,10 C下可逆比容量高达157.8 mAh/g和1 C循环800次后容量保持率为77.4%.Shen等[38 ] 在LiNi0.55 Co0.15 Mn0.3 O2 材料上掺杂Zr且表面包覆B2 O3 ,通过Zr和B2 O3 的协同作用,使材料能在长期充放电过程中保持稳定,从而改善材料的高压性能和长循环性能.这些双重改性使用的大多为贵重元素,工艺复杂且成本较高,不利于产业化生产.目前,通过结构掺杂与表面包覆相结合的方式对NCM811材料进行改性的研究相对较少;而且,未曾发现通过共沉淀法在前驱体制备过程中掺杂Mg元素并进一步利用液相法在材料表面涂上Al2 O3 保护层对NCM811材料进行改性研究. ...
1
... 近年来,科研人员发现将结构掺杂与表面包覆结合形成的协同作用能够进一步提升高镍层状三元材料的电化学性能[34 -35 ] .Yu等[36 ] 通过在LiNi0.9 Co0.1 O2 材料上掺杂Mg和表面涂覆聚吡咯的双重改性策略,将镁离子充当柱状离子改善阳离子无序程度,疏通晶格中的Li+ 扩散通道;导电聚吡咯涂层增强固体电解质界面处的电荷转移,并有效防止表面副反应的发生,使得材料具有高倍率和长寿命.Yang等[37 ] 使用聚阴离子PO4 3 - 2 TiO3 包覆对NCM622材料进行集成改性,PO4 3 - 2 TiO3 涂层可抑制副反应并降低离子传输阻抗,使得材料在高截止电压(4.5 V)下表现出优异的倍率性能和循环稳定性,10 C下可逆比容量高达157.8 mAh/g和1 C循环800次后容量保持率为77.4%.Shen等[38 ] 在LiNi0.55 Co0.15 Mn0.3 O2 材料上掺杂Zr且表面包覆B2 O3 ,通过Zr和B2 O3 的协同作用,使材料能在长期充放电过程中保持稳定,从而改善材料的高压性能和长循环性能.这些双重改性使用的大多为贵重元素,工艺复杂且成本较高,不利于产业化生产.目前,通过结构掺杂与表面包覆相结合的方式对NCM811材料进行改性的研究相对较少;而且,未曾发现通过共沉淀法在前驱体制备过程中掺杂Mg元素并进一步利用液相法在材料表面涂上Al2 O3 保护层对NCM811材料进行改性研究. ...
1
... 近年来,科研人员发现将结构掺杂与表面包覆结合形成的协同作用能够进一步提升高镍层状三元材料的电化学性能[34 -35 ] .Yu等[36 ] 通过在LiNi0.9 Co0.1 O2 材料上掺杂Mg和表面涂覆聚吡咯的双重改性策略,将镁离子充当柱状离子改善阳离子无序程度,疏通晶格中的Li+ 扩散通道;导电聚吡咯涂层增强固体电解质界面处的电荷转移,并有效防止表面副反应的发生,使得材料具有高倍率和长寿命.Yang等[37 ] 使用聚阴离子PO4 3 - 2 TiO3 包覆对NCM622材料进行集成改性,PO4 3 - 2 TiO3 涂层可抑制副反应并降低离子传输阻抗,使得材料在高截止电压(4.5 V)下表现出优异的倍率性能和循环稳定性,10 C下可逆比容量高达157.8 mAh/g和1 C循环800次后容量保持率为77.4%.Shen等[38 ] 在LiNi0.55 Co0.15 Mn0.3 O2 材料上掺杂Zr且表面包覆B2 O3 ,通过Zr和B2 O3 的协同作用,使材料能在长期充放电过程中保持稳定,从而改善材料的高压性能和长循环性能.这些双重改性使用的大多为贵重元素,工艺复杂且成本较高,不利于产业化生产.目前,通过结构掺杂与表面包覆相结合的方式对NCM811材料进行改性的研究相对较少;而且,未曾发现通过共沉淀法在前驱体制备过程中掺杂Mg元素并进一步利用液相法在材料表面涂上Al2 O3 保护层对NCM811材料进行改性研究. ...
1
... 近年来,科研人员发现将结构掺杂与表面包覆结合形成的协同作用能够进一步提升高镍层状三元材料的电化学性能[34 -35 ] .Yu等[36 ] 通过在LiNi0.9 Co0.1 O2 材料上掺杂Mg和表面涂覆聚吡咯的双重改性策略,将镁离子充当柱状离子改善阳离子无序程度,疏通晶格中的Li+ 扩散通道;导电聚吡咯涂层增强固体电解质界面处的电荷转移,并有效防止表面副反应的发生,使得材料具有高倍率和长寿命.Yang等[37 ] 使用聚阴离子PO4 3 - 2 TiO3 包覆对NCM622材料进行集成改性,PO4 3 - 2 TiO3 涂层可抑制副反应并降低离子传输阻抗,使得材料在高截止电压(4.5 V)下表现出优异的倍率性能和循环稳定性,10 C下可逆比容量高达157.8 mAh/g和1 C循环800次后容量保持率为77.4%.Shen等[38 ] 在LiNi0.55 Co0.15 Mn0.3 O2 材料上掺杂Zr且表面包覆B2 O3 ,通过Zr和B2 O3 的协同作用,使材料能在长期充放电过程中保持稳定,从而改善材料的高压性能和长循环性能.这些双重改性使用的大多为贵重元素,工艺复杂且成本较高,不利于产业化生产.目前,通过结构掺杂与表面包覆相结合的方式对NCM811材料进行改性的研究相对较少;而且,未曾发现通过共沉淀法在前驱体制备过程中掺杂Mg元素并进一步利用液相法在材料表面涂上Al2 O3 保护层对NCM811材料进行改性研究. ...
1
... 近年来,科研人员发现将结构掺杂与表面包覆结合形成的协同作用能够进一步提升高镍层状三元材料的电化学性能[34 -35 ] .Yu等[36 ] 通过在LiNi0.9 Co0.1 O2 材料上掺杂Mg和表面涂覆聚吡咯的双重改性策略,将镁离子充当柱状离子改善阳离子无序程度,疏通晶格中的Li+ 扩散通道;导电聚吡咯涂层增强固体电解质界面处的电荷转移,并有效防止表面副反应的发生,使得材料具有高倍率和长寿命.Yang等[37 ] 使用聚阴离子PO4 3 - 2 TiO3 包覆对NCM622材料进行集成改性,PO4 3 - 2 TiO3 涂层可抑制副反应并降低离子传输阻抗,使得材料在高截止电压(4.5 V)下表现出优异的倍率性能和循环稳定性,10 C下可逆比容量高达157.8 mAh/g和1 C循环800次后容量保持率为77.4%.Shen等[38 ] 在LiNi0.55 Co0.15 Mn0.3 O2 材料上掺杂Zr且表面包覆B2 O3 ,通过Zr和B2 O3 的协同作用,使材料能在长期充放电过程中保持稳定,从而改善材料的高压性能和长循环性能.这些双重改性使用的大多为贵重元素,工艺复杂且成本较高,不利于产业化生产.目前,通过结构掺杂与表面包覆相结合的方式对NCM811材料进行改性的研究相对较少;而且,未曾发现通过共沉淀法在前驱体制备过程中掺杂Mg元素并进一步利用液相法在材料表面涂上Al2 O3 保护层对NCM811材料进行改性研究. ...
1
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 实验通过X射线衍射(XRD)对Mg0、Mg1.0及Mg1.0@Al三种活性材料的晶体结构进行分析,图2 (a)显示Mg0材料特征峰与标准卡片PDF#74-0919一致,是六方α -NaFeO2 结构,为R -3 m 空间群;且(006)/(012)和(018)/(110)所呈现的两组峰分裂明显,说明材料具有明显的层状结构[39 -40 ] .掺杂Mg和包覆Al2 O3 后未观察到杂峰出现,证实Mg成功代替材料中的Mn,并且Al2 O3 包覆不会改变材料晶体结构[23 ] .I (003)/I (104)比值能体现材料的锂镍混排程度,通常认为该值大于1.2时,材料锂镍混排较小[11 ,41 ] .当锂镍混排越小时,锂层中的Li+ 位点被Ni2+ 占据越少,在充放电过程中能够提供更多的锂离子,从而使材料表现出更优异的电化学性能.图2 (a)计算得到Mg0、Mg1.0及Mg1.0@Al的I (003)/I (104)比值分别为1.32、1.71及1.68,掺杂Mg后材料的锂镍混合程度明显减小,说明掺杂Mg能够有效抑制阳离子混排;同时,改性后材料的特征峰(003)强度明显上升,表明掺杂Mg能够增强材料结晶性,这是由于Mg离子的加入为材料提供更稳定的Mg—O键[25 ] .(003)特征峰放大图显示[图2 (b)],掺杂Mg后(003)特征峰向左偏移,这是由于Mg2+ 半径较大,掺杂Mg后会导致晶格发生膨胀,晶面间距扩大,衍射角度相应缩小[25 ] ,证实掺杂Mg能够扩大材料的层间距.此外,观察到包覆Al2 O3 后,Mg1.0@Al和Mg1.0特征峰偏移量基本一致,进一步证明Al2 O3 涂层对材料晶体结构未造成影响. ...
1
... 本研究所有电化学测试的电池均是以锂片为对电极的半电池体系(Li || NCM811),图4 (a)为Mg0、Mg1.0和Mg1.0@Al材料在0.1 mV/s、电压范围3~4.3 V下循环前三次的循环伏安(CV)曲线.曲线中出现由相转变引起的三对氧化还原峰,从低压区到高压区,分别为六方相到单斜相(H1-M),单斜相到六方相(M-H2)和六方相到六方相(H2-H3)[42 ] .首次循环中氧化峰电位发生偏移是由于首次充电过程中电解液与活性材料发生不可逆反应生成固体电解质界面(SEI)膜导致的,其氧化还原峰之间的电位差(ΔE )代表了电极极化,极化越小说明材料的循环和倍率性能优异[24 ] .Mg0材料在首次ΔE 为0.260 V,掺杂Mg后,材料电位差下降至0.173 V,这是由于Mg—O键能够稳定材料结构,并且掺杂Mg有效地缓解了材料阳离子混乱程度,因而表现出较低的电位差[25 ] .Mg1.0@Al材料首次ΔE 为0.161 V,电位差较Mg1.0材料明显下降,这归因于Al2 O3 涂层有效抑制了副反应的发生,进一步稳定材料结构,减少了不可逆容量[23 ] .同时,Mg1.0@Al材料第二、第三次循环曲线重合度较高,说明Mg1.0@Al材料具有良好的可逆性. ...
2
... 图4 (b)为Mg0、Mg1.0和Mg1.0@Al材料在1 C下循环100次后的交流阻抗(EIS)图,其由高频区域的半圆和低频区的斜线两部分组成.插图为材料EIS曲线的等效电路模型,R s 表示存在于工作电极和参比电极之间的内部欧姆电阻;CPE为电极/电解质之间的电容;R ct 表示电荷转移阻抗,代表样品颗粒表面上Li+ 传输的界面反应的电荷转移阻力;W o 代表Warburg阻抗,显示Li+ 在电极中的迁移速率[43 ] .通过Zview软件拟合得到各元件数值(表1 ),Mg0、Mg1.0和Mg1.0@Al三个材料在经过100次循环后,欧姆阻抗(R s )分别为8.55 Ω、16.55 Ω和10.00 Ω,改性前后材料R s 相似,表明测试条件一致[44 ] .Mg0材料的电荷转移阻抗R ct 为113.70 Ω,掺杂Mg后,Mg1.0材料的电荷转移阻抗值(R ct =66.37 Ω)明显缩减,因为Mg掺杂能够提高材料的化学稳定性,形成稳定的SEI膜[25 ,45 ] ;同时观察到Mg1.0@Al材料的R ct 为51.66 Ω,比Mg1.0材料略低,表明涂层有效防止电解液对材料表面的腐蚀,进一步稳定材料结构[43 ] .图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
... [43 ].图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
1
... 图4 (b)为Mg0、Mg1.0和Mg1.0@Al材料在1 C下循环100次后的交流阻抗(EIS)图,其由高频区域的半圆和低频区的斜线两部分组成.插图为材料EIS曲线的等效电路模型,R s 表示存在于工作电极和参比电极之间的内部欧姆电阻;CPE为电极/电解质之间的电容;R ct 表示电荷转移阻抗,代表样品颗粒表面上Li+ 传输的界面反应的电荷转移阻力;W o 代表Warburg阻抗,显示Li+ 在电极中的迁移速率[43 ] .通过Zview软件拟合得到各元件数值(表1 ),Mg0、Mg1.0和Mg1.0@Al三个材料在经过100次循环后,欧姆阻抗(R s )分别为8.55 Ω、16.55 Ω和10.00 Ω,改性前后材料R s 相似,表明测试条件一致[44 ] .Mg0材料的电荷转移阻抗R ct 为113.70 Ω,掺杂Mg后,Mg1.0材料的电荷转移阻抗值(R ct =66.37 Ω)明显缩减,因为Mg掺杂能够提高材料的化学稳定性,形成稳定的SEI膜[25 ,45 ] ;同时观察到Mg1.0@Al材料的R ct 为51.66 Ω,比Mg1.0材料略低,表明涂层有效防止电解液对材料表面的腐蚀,进一步稳定材料结构[43 ] .图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
1
... 图4 (b)为Mg0、Mg1.0和Mg1.0@Al材料在1 C下循环100次后的交流阻抗(EIS)图,其由高频区域的半圆和低频区的斜线两部分组成.插图为材料EIS曲线的等效电路模型,R s 表示存在于工作电极和参比电极之间的内部欧姆电阻;CPE为电极/电解质之间的电容;R ct 表示电荷转移阻抗,代表样品颗粒表面上Li+ 传输的界面反应的电荷转移阻力;W o 代表Warburg阻抗,显示Li+ 在电极中的迁移速率[43 ] .通过Zview软件拟合得到各元件数值(表1 ),Mg0、Mg1.0和Mg1.0@Al三个材料在经过100次循环后,欧姆阻抗(R s )分别为8.55 Ω、16.55 Ω和10.00 Ω,改性前后材料R s 相似,表明测试条件一致[44 ] .Mg0材料的电荷转移阻抗R ct 为113.70 Ω,掺杂Mg后,Mg1.0材料的电荷转移阻抗值(R ct =66.37 Ω)明显缩减,因为Mg掺杂能够提高材料的化学稳定性,形成稳定的SEI膜[25 ,45 ] ;同时观察到Mg1.0@Al材料的R ct 为51.66 Ω,比Mg1.0材料略低,表明涂层有效防止电解液对材料表面的腐蚀,进一步稳定材料结构[43 ] .图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
1
... 图4 (b)为Mg0、Mg1.0和Mg1.0@Al材料在1 C下循环100次后的交流阻抗(EIS)图,其由高频区域的半圆和低频区的斜线两部分组成.插图为材料EIS曲线的等效电路模型,R s 表示存在于工作电极和参比电极之间的内部欧姆电阻;CPE为电极/电解质之间的电容;R ct 表示电荷转移阻抗,代表样品颗粒表面上Li+ 传输的界面反应的电荷转移阻力;W o 代表Warburg阻抗,显示Li+ 在电极中的迁移速率[43 ] .通过Zview软件拟合得到各元件数值(表1 ),Mg0、Mg1.0和Mg1.0@Al三个材料在经过100次循环后,欧姆阻抗(R s )分别为8.55 Ω、16.55 Ω和10.00 Ω,改性前后材料R s 相似,表明测试条件一致[44 ] .Mg0材料的电荷转移阻抗R ct 为113.70 Ω,掺杂Mg后,Mg1.0材料的电荷转移阻抗值(R ct =66.37 Ω)明显缩减,因为Mg掺杂能够提高材料的化学稳定性,形成稳定的SEI膜[25 ,45 ] ;同时观察到Mg1.0@Al材料的R ct 为51.66 Ω,比Mg1.0材料略低,表明涂层有效防止电解液对材料表面的腐蚀,进一步稳定材料结构[43 ] .图4 (c)为Z ' 和ω -1/2 的线性拟合图,锂离子扩散系数可由式(1) 计算[46 ] : ...
1
... Mg1.0材料的D Li 计算值为2.46×10-14 cm2 /s,约为未改性Mg0材料(D Li =5.62×10-15 cm2 /s)的6.64倍,这归因于Mg离子取代Mn离子位点,扩大了材料晶胞,拓宽锂层间距,有利于Li+ 的脱嵌,增加材料的导电性[26 ] .Mg1.0@Al的D Li 为4.05×10-14 cm2 /s,约为Mg1.0材料的1.65倍、Mg0材料的7.21倍,说明在不断的充放电过程中,Al2 O3 涂覆层有效地抑制NCM811材料表面与电解液之间的副反应,稳定材料结构,为Li+ 提供了稳定的传输通道,使得NCM811材料表现出优异的锂离子扩散系数[47 -48 ] .图4 (d)显示了Mg0和Mg1.0@Al材料在2.8~4.3 V下,1 C循环100次后锂片表面情况,明显观察到锂片表面变黑,这是由于NCM811材料中Mn的溶解,变成黑色的Mn4+ 固体化合物[49 ] ,穿过隔膜附着在锂片上.改性后的Mg1.0@Al材料较未改性的Mg0材料在经历长循环后,锂片表面黑色物质明显较少,表明Al2 O3 涂层能够有效抑制NCM811材料表面与电解液之间的副反应,有效缓解Mn2+ 溶解. ...
1
... Mg1.0材料的D Li 计算值为2.46×10-14 cm2 /s,约为未改性Mg0材料(D Li =5.62×10-15 cm2 /s)的6.64倍,这归因于Mg离子取代Mn离子位点,扩大了材料晶胞,拓宽锂层间距,有利于Li+ 的脱嵌,增加材料的导电性[26 ] .Mg1.0@Al的D Li 为4.05×10-14 cm2 /s,约为Mg1.0材料的1.65倍、Mg0材料的7.21倍,说明在不断的充放电过程中,Al2 O3 涂覆层有效地抑制NCM811材料表面与电解液之间的副反应,稳定材料结构,为Li+ 提供了稳定的传输通道,使得NCM811材料表现出优异的锂离子扩散系数[47 -48 ] .图4 (d)显示了Mg0和Mg1.0@Al材料在2.8~4.3 V下,1 C循环100次后锂片表面情况,明显观察到锂片表面变黑,这是由于NCM811材料中Mn的溶解,变成黑色的Mn4+ 固体化合物[49 ] ,穿过隔膜附着在锂片上.改性后的Mg1.0@Al材料较未改性的Mg0材料在经历长循环后,锂片表面黑色物质明显较少,表明Al2 O3 涂层能够有效抑制NCM811材料表面与电解液之间的副反应,有效缓解Mn2+ 溶解. ...
1
... Mg1.0材料的D Li 计算值为2.46×10-14 cm2 /s,约为未改性Mg0材料(D Li =5.62×10-15 cm2 /s)的6.64倍,这归因于Mg离子取代Mn离子位点,扩大了材料晶胞,拓宽锂层间距,有利于Li+ 的脱嵌,增加材料的导电性[26 ] .Mg1.0@Al的D Li 为4.05×10-14 cm2 /s,约为Mg1.0材料的1.65倍、Mg0材料的7.21倍,说明在不断的充放电过程中,Al2 O3 涂覆层有效地抑制NCM811材料表面与电解液之间的副反应,稳定材料结构,为Li+ 提供了稳定的传输通道,使得NCM811材料表现出优异的锂离子扩散系数[47 -48 ] .图4 (d)显示了Mg0和Mg1.0@Al材料在2.8~4.3 V下,1 C循环100次后锂片表面情况,明显观察到锂片表面变黑,这是由于NCM811材料中Mn的溶解,变成黑色的Mn4+ 固体化合物[49 ] ,穿过隔膜附着在锂片上.改性后的Mg1.0@Al材料较未改性的Mg0材料在经历长循环后,锂片表面黑色物质明显较少,表明Al2 O3 涂层能够有效抑制NCM811材料表面与电解液之间的副反应,有效缓解Mn2+ 溶解. ...
1
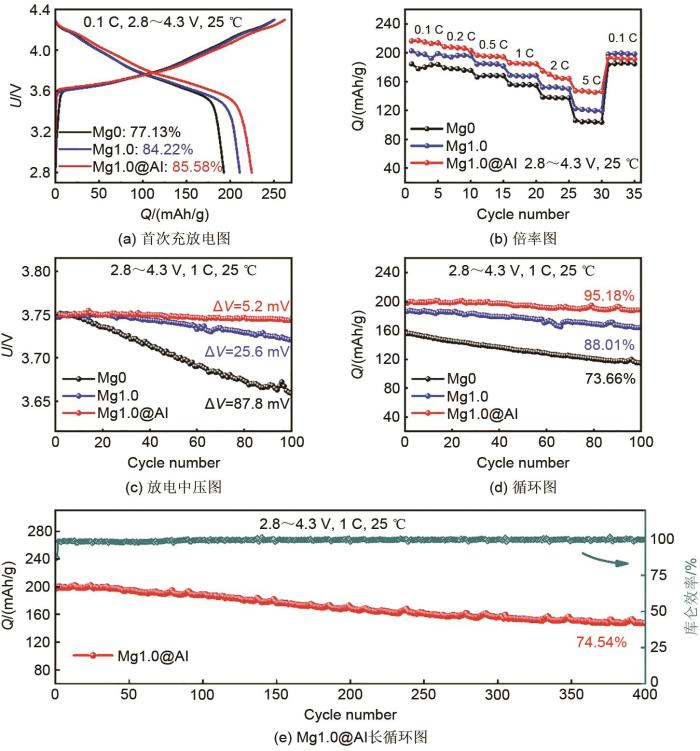
... 实验在25 ℃、2.8~4.3 V下,对Mg0、Mg1.0及Mg1.0@Al三种材料进行充放电性能分析,深入研究Mg掺杂及Al2 O3 包覆对NCM811材料电化学性能的影响.图5 (a)揭示了Mg0、Mg1.0及Mg1.0@Al三种材料在0.1 C下首次充放电曲线,Mg0材料首次库仑效率为77.13%,放电比容量为192.9 mAh/g,Mg改性后Mg1.0材料首次循环效率明显提升至84.22%,放电比容量上升至211.0 mAh/g,这得益于Mg2+ 扩大了材料层间距,抑制了材料锂镍混排,使得Li+ 更容易脱嵌[50 ] .经过Al2 O3 包覆后,Mg1.0@Al材料首次库仑效率高达85.58%,放电比容量为224.6 mAh/g,表明Al2 O3 涂层有效抑制电解液对材料表面的腐蚀,减少Li+ 的损耗,稳固材料结构,进一步提高NCM811材料的首次库仑效率.图5 (b)呈现了Mg0、Mg1.0及Mg1.0@Al三种材料在不同电流密度下的放电能力,Mg0材料在0.1 C、0.2 C、0.5 C、1.0 C、2.0 C和5.0 C(1 C=180 mAh/g)下的放电比容量分别为180.1 mAh/g、177.9 mAh/g、168.5 mAh/g、155.9 mAh/g、137.6 mAh/g和105.0 mAh/g;Mg1.0材料放电比容量分别为197.8 mAh/g、196.3 mAh/g、184.8 mAh/g、167.7 mAh/g、152.6 mAh/g和120.8 mAh/g;Mg1.0@Al材料放电比容量分别为215.0 mAh/g、207.2 mAh/g、195.1 mAh/g、185.2 mAh/g、166.0 mAh/g和146.3 mAh/g.观察到材料改性后的放电能力明显提升,5 C大倍率电流下,Mg1.0@Al材料较Mg0和Mg1.0材料放电比容量大约提升了71.9 mAh/g和25.5 mAh/g,这是因为镁铝协同改性使得材料具有宽阔的层间距和有效抑制副反应发生的涂层,能够为材料中Li+ 脱嵌提供宽阔稳定的桥梁[51 ] ,从而表现出优异的倍率性能,该结果与XRD和CV结果一致. ...
1
... 实验在25 ℃、2.8~4.3 V下,对Mg0、Mg1.0及Mg1.0@Al三种材料进行充放电性能分析,深入研究Mg掺杂及Al2 O3 包覆对NCM811材料电化学性能的影响.图5 (a)揭示了Mg0、Mg1.0及Mg1.0@Al三种材料在0.1 C下首次充放电曲线,Mg0材料首次库仑效率为77.13%,放电比容量为192.9 mAh/g,Mg改性后Mg1.0材料首次循环效率明显提升至84.22%,放电比容量上升至211.0 mAh/g,这得益于Mg2+ 扩大了材料层间距,抑制了材料锂镍混排,使得Li+ 更容易脱嵌[50 ] .经过Al2 O3 包覆后,Mg1.0@Al材料首次库仑效率高达85.58%,放电比容量为224.6 mAh/g,表明Al2 O3 涂层有效抑制电解液对材料表面的腐蚀,减少Li+ 的损耗,稳固材料结构,进一步提高NCM811材料的首次库仑效率.图5 (b)呈现了Mg0、Mg1.0及Mg1.0@Al三种材料在不同电流密度下的放电能力,Mg0材料在0.1 C、0.2 C、0.5 C、1.0 C、2.0 C和5.0 C(1 C=180 mAh/g)下的放电比容量分别为180.1 mAh/g、177.9 mAh/g、168.5 mAh/g、155.9 mAh/g、137.6 mAh/g和105.0 mAh/g;Mg1.0材料放电比容量分别为197.8 mAh/g、196.3 mAh/g、184.8 mAh/g、167.7 mAh/g、152.6 mAh/g和120.8 mAh/g;Mg1.0@Al材料放电比容量分别为215.0 mAh/g、207.2 mAh/g、195.1 mAh/g、185.2 mAh/g、166.0 mAh/g和146.3 mAh/g.观察到材料改性后的放电能力明显提升,5 C大倍率电流下,Mg1.0@Al材料较Mg0和Mg1.0材料放电比容量大约提升了71.9 mAh/g和25.5 mAh/g,这是因为镁铝协同改性使得材料具有宽阔的层间距和有效抑制副反应发生的涂层,能够为材料中Li+ 脱嵌提供宽阔稳定的桥梁[51 ] ,从而表现出优异的倍率性能,该结果与XRD和CV结果一致. ...
1
... 进一步测试材料1 C下循环100次后的电化学稳定性[图5 (c)、5 (d)],观察到随着充放电次数的增加,材料放电中压不断下降[图5 (c)].Mg0材料的电压差(ΔV )为87.8 mV,改性后,Mg1.0材料的ΔV 为25.6 mV,明显比Mg0材料具有更稳定的放电电压,这是由于Mg—O键的存在,使得材料结构在充放电过程中能够保持稳定[26 ] .同时,Mg1.0@Al材料较Mg1.0材料表现出更稳定的放电中压(ΔV =5.2 mV),这归因于Al2 O3 涂层对材料表面的保护,进一步稳定材料的结构[23 ] .循环稳定性测试显示[图5 (d)],Mg0材料的放电比容量和容量保持率分别为114.51 mAh/g和73.66%;改性后,Mg1.0材料的循环稳定性明显上升,放电比容量和容量保持率分别为164.20 mAh/g和88.01%,进一步证明Mg—O键能够稳定材料结构[26 ] .同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...
1
... 进一步测试材料1 C下循环100次后的电化学稳定性[图5 (c)、5 (d)],观察到随着充放电次数的增加,材料放电中压不断下降[图5 (c)].Mg0材料的电压差(ΔV )为87.8 mV,改性后,Mg1.0材料的ΔV 为25.6 mV,明显比Mg0材料具有更稳定的放电电压,这是由于Mg—O键的存在,使得材料结构在充放电过程中能够保持稳定[26 ] .同时,Mg1.0@Al材料较Mg1.0材料表现出更稳定的放电中压(ΔV =5.2 mV),这归因于Al2 O3 涂层对材料表面的保护,进一步稳定材料的结构[23 ] .循环稳定性测试显示[图5 (d)],Mg0材料的放电比容量和容量保持率分别为114.51 mAh/g和73.66%;改性后,Mg1.0材料的循环稳定性明显上升,放电比容量和容量保持率分别为164.20 mAh/g和88.01%,进一步证明Mg—O键能够稳定材料结构[26 ] .同时由于Al2 O3 涂层能有效地防止材料中Mn与电解液中痕量的水反应生成Mn3+ ,进一步稳定材料结构,延长了材料的使用寿命[52 -53 ] ,使得Mg1.0@Al材料循环100次后,放电比容量仍有188.58 mAh/g,容量保持率高达95.18%,表现出优越的循环稳定性.对Mg1.0@Al材料进行长循环测试表明[图5 (e)],在1 C下循环400次后放电比容量仍有147.47 mAh/g,容量保持率为74.54%,相较于未改性的Mg0材料,Mg1.0@Al材料表现出卓越的放电比容量和容量保持率,这得益于Mg掺杂协同Al2 O3 包覆能够有效遏制材料在长循环过程中相转变引起的结构坍塌,为材料提供了良好的Li+ 脱嵌通道,使得材料具有卓越的循环性能,表明镁铝协同作用对NCM811材料突出的促进作用. ...